
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ③⑤⑥ |
分析 对于COCl2(g)?CO(g)+Cl2(g)△H>0,正反应为吸热反应,反应物气体的计量数小于生成物气体的计量数之和,如提高COCl2转化率,可使平衡正向移动,结合温度、压强以及浓度对平衡移动的影响解答该题.
解答 解:化学反应COCl2(g)?CO(g)+Cl2(g)△H>0,正反应是气体体积增大的吸热反应,
①升温平衡向正反应移动,COCl2转化率增大,故①正确;
②恒容通入惰性气体,总压增大,反应混合物各组分的浓度不变,平衡不移动,COCl2转化率不变,故②错误;
③增加CO的浓度,平衡向逆反应方向移动,COCl2转化率减小故③错误;
④减压平衡向正反应方向移动,COCl2转化率增大,故④正确;
⑤加催化剂,改变速率不改变平衡,COCl2转化率不变,故⑤错误;
⑥恒压通入惰性气体,压强增大,为保持恒压,体积增大压强减小,平衡正向进行,COCl2转化率增大,故⑥正确,
故选B.
点评 本题考查了化学平衡的影响因素,为高频考点,注意理解通入惰性气体对平衡移动影响,题目难度中等,侧重于考查学生对化学平衡移动原理的掌握情况.


科目:高中化学 来源: 题型:多选题
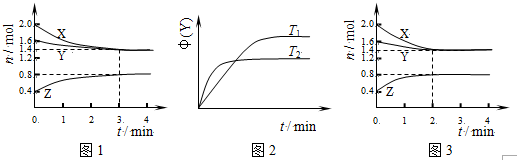
| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 反应进行的前3min内,用X表示的反应速率v(X)=0.2mol•(L•min)-1 | |
| C. | 保持其他条件不变,升高温度,反应的化学平衡常数K减小 | |
| D. | 其它条件不变,使用催化剂,则反应进程可能如图3所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9:1 | B. | 10:1 | C. | 1:10 | D. | 9:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3•H2O | |
| B. | 2NO2+2OH-=NO3-+NO2-+H2O | |
| C. | SnCl4+2H2O=SnO2+4HCl | |
| D. | CO32-+CO2+H2O=2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | VA=0.15 mol•L-1•min-1 | B. | VC=0.6 mol•L-1•min-1 | ||
| C. | VB=0.6 mol•L-1•min-1 | D. | VD=0.1 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质--铝 石墨 氮气 | |
| B. | 混合物--空气 粗盐 牛奶 | |
| C. | 碱--烧碱 纯碱 熟石灰 | |
| D. | 氧化物--氧化铜 二氧化锰 二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若2CH3OH(1)+3O2(g)═2CO2(g)+2H2O(g)△H=-1478KJ/mol,则CH3OH(1)的燃烧热为739KJ/mol | |
| B. | 若P4(白磷,s)═4P(红磷,s)△H<0,则红磷比白磷稳定 | |
| C. | 已知H+(aq)+OH-(aq)═H2O(1)△H=-57.3KJ/mol,则20.0g NaOH固体与稀盐酸完全中和,放出28.65KJ的热量 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1; 2C(s)+O2(g)=2CO(g)△H2;△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
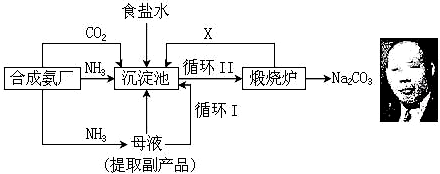
温度 盐 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
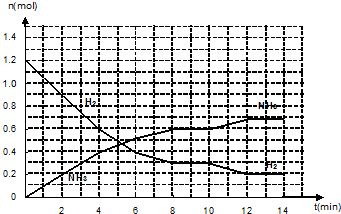
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com