
【题目】将H2S转化为可再利用的资源是能源研究领域的重要课题。
(1)H2S的转化
Ⅰ | 克劳斯法 |
|
Ⅱ | 铁盐氧化法 |
|
Ⅲ | 光分解法 |
|
① 反应Ⅰ的化学方程式是________。
② 反应Ⅱ:____+ 1 H2S ==____Fe2+ + ____S↓ + ____(将反应补充完整)。
③ 反应Ⅲ体现了H2S的稳定性弱于H2O。结合原子结构解释二者稳定性差异的原因:_______。
(2)反应Ⅲ硫的产率低,反应Ⅱ的原子利用率低。我国科研人员设想将两个反应耦合,实现由H2S高效产生S和H2,电子转移过程如图。
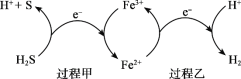
过程甲、乙中,氧化剂分别是______。
(3)按照设计,科研人员研究如下。
① 首先研究过程乙是否可行,装置如图。经检验,n极区产生了Fe3+,p极产生了H2。n极区产生Fe3+的可能原因:
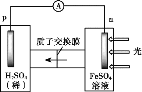
ⅰ.Fe2+ - e- = Fe3+
ⅱ.2H2O -4e-=O2 +4H+,_______(写离子方程式)。经确认,ⅰ是产生Fe3+的原因。过程乙可行。
② 光照产生Fe3+后,向n极区注入H2S溶液,有S生成,持续产生电流,p极产生H2。研究S产生的原因,设计如下实验方案:______。 经确认,S是由Fe3+氧化H2S所得,H2S不能直接放电。过程甲可行。
(4)综上,反应Ⅱ、Ⅲ能耦合,同时能高效产生H2和S,其工作原理如图。
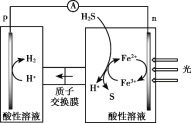
进一步研究发现,除了Fe3+/Fe2+ 外,I3-/I- 也能实现如图所示循环过程。结合化学用语,说明I3-/I- 能够使S源源不断产生的原因:________。
【答案】![]() ↓ 2Fe3+ 2 1 2H+ O与S位于同主族,原子半径S>O,得电子能力S<O,非金属性S<O,氢化物稳定性H2S<H2O
↓ 2Fe3+ 2 1 2H+ O与S位于同主族,原子半径S>O,得电子能力S<O,非金属性S<O,氢化物稳定性H2S<H2O ![]() 、
、![]()
![]() 将
将![]() 溶液换成
溶液换成![]() 溶液
溶液 ![]() 在电极上放电:
在电极上放电:![]() 。
。![]() 在溶液中氧化
在溶液中氧化![]() :
:![]() 。
。![]() 和
和![]() 循环反应。
循环反应。
【解析】
(1)H2S具有较强的还原性,利用氧化还原反应将其转化为S,据此分析;
(2)氧化剂具有氧化性,易得电子,化合价降低,据此作答;
(3)根据光能转化成化学能,化学能转化为电能,讨论负极发生的电极反应;
(4)根据电解质溶液中正负极反应方程式,及各物质的转化关系作答。
(1)①H2S在氧气氧化作用下生成S,其化学方程式为:![]() ↓;
↓;
②H2S为Fe3+氧化为S,依据氧化还原反应规律可知,其离子方程式为:2 Fe3++ 1 H2S ==2Fe2+ + S↓ +2H+,故答案为:2 Fe3+:2;1:2H+;
③O与S位于同主族,原子半径S>O,得电子能力S<O,非金属性S<O,氢化物稳定性H2S<H2O;
(2)过程甲中,S元素化合价从-2价升高到0价,Fe元素从+3降低到+2价,则氧化剂为Fe3+;过程乙中,Fe元素从+2升高到+3价,H元素化合价从+1价降低到0价,则氧化剂为H+;
(3)n极区产生了Fe3+,p极产生了H2,则n极为氧化反应,是原电池的负极,p极发生了还原反应是原电池的正极,负极区,除了Fe2+失电子生成Fe3+以外,也可能是水失电子生成的氧气将Fe2+氧化成Fe3+所致,其离子方程式为:2H2O -4e-=O2 +4H+,![]() ;
;
②为了研究S是由于H2S失电子发生氧化反应产生的,避免溶液中其他离子的干扰,需要将将![]() 溶液换成
溶液换成![]() 溶液,进行验证。
溶液,进行验证。
(4)根据上述工作原理可知,I3-/I- 能够使S源源不断产生,主要是因为在电极上放电:
![]() 。
。![]() 在溶液中氧化
在溶液中氧化![]() :
:![]() 。
。![]() 和
和![]() 循环反应。
循环反应。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】25℃,向20mL 0.1mol·L-1MOH溶液中滴加0.1mol·L-1 CH3COOH溶液,所得溶液的pH(对应曲线M)及导电能力(对应曲线N)变化如图所示。下列叙述正确的是( )

A. MOH是强碱
B. b点溶液中,c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1
C. 水的离子积常数Kw:b>c>a
D. c点溶液中,c(CH3COO-)>c(M+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅高温陶瓷材料是现代重要的结构陶瓷,因其有硬度大、熔点高、化学性质稳定等特点而受到广泛关注。工业上普遍用下列流程进行生产:

(1)SiO2和C反应除了得到粗硅外,还有可能得到一种硬度也很大的物质SiC,是生成粗硅还是生成该物质主要是由___决定的。
(2)反应①的条件是隔绝空气和____。
(3)写出制粗硅的反应的化学方程式____。
(4)写出硅与氢氧化钠溶液的离子方程式____。
(5)现在是用四氯化硅、氮气、氢气在稀有气体保护下加强热,得到纯度较高的氮化硅,其反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.15mol的MnO2与过量的12mol/L的浓盐酸反应,与50ml 12mol/L的浓盐酸与过量MnO2反应,两者产生的氯气相比(其它反应条件相同)
A.一样多 B.前者较后者多 C.后者较前者多 D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。刻蚀印刷电路板涉及的离子方程式为___,检验溶液中还有Fe3+的试剂是___。
(2)工业上制取漂白粉的化学反应方程式为___,漂白粉在空气中表现漂白性的原理是___,除去氯气中混有的氯化氢气体的方法是将气体通过___溶液中。
(3)铝分别与足量的NaOH溶液和稀硫酸反应,若两个反应在相同状况下放出等量的气体,则两个反应中消耗的铝的物质的量之比为___。
(4)玻璃烧制过程中发生的反应有___。
(5)在标准状况下,由CO和CO2组成的混合气体6.72L,质量为12g。此混合物中CO和CO2物质的量之比是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法中正确的是( )
A.0.1mol/L Na2SO4溶于水中,所得溶液中Na+个数为0.2NA
B.78g Na2O2中含有离子总数为3NA
C.标准状况下,NA个水分子所占的体积为22.4L
D.Na2O2与CO2反应生成2.24L氧气转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋动物海鞘中含有种类丰富、结构新颖的次生代谢产物,是海洋抗肿瘤活性物质的重要来源之一。一种从海鞘中提取具有抗肿瘤活性的天然产物的流程如下:
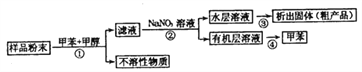
下列关于该流程中各步骤的说法中,错误的是( )
选项 | 步骤 | 采用装置 | 主要仪器 |
A | ① | 过滤装置 | 漏斗 |
B | ② | 分液装置 | 分液漏斗 |
C | ③ | 蒸发装置 | 坩埚 |
D | ④ | 蒸馏装置 | 蒸馏烧瓶 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废气中的 H2S 通过高温热分解可制取氢气:2H2S(g) ![]() 2H2(g)+S2(g)。现在 3L 密闭容器中,控制不同 温度进行 H2S 分解实验。
2H2(g)+S2(g)。现在 3L 密闭容器中,控制不同 温度进行 H2S 分解实验。
(1)某温度时,测得反应体系中有气体 1.31mol,反应 tmin 后,测得气体为 1.37mol,则 tmin 内 H2 的生成 速率为___________________。
(2) 某温度时,可作为判断反应达到平衡的标志依据是_____(选填编号)。
a. 气体的压强不发生变化 b. 气体的密度不发生变化
(3)实验结果如图。图中曲线 a 表示 H2S 的平衡转化率与温度关系,曲线b 表示不同温度下、反应经过相同时间且未达到化学平衡时 H2S 的转化率。
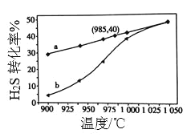
该反应为________反应(填“放热”或“吸热”)。在容器体积不变的情况下, 如果要提高 H2的体积分数,可采取的一种措施是_______________________
(4)使 1LH2S 与 20L 空气(空气中 O2 体积分数为 0.2)完全反应后恢复到室温,混合气体的体积是________L。若 2gH2S 完全燃烧后生成二氧化硫和水蒸气,同时放出 29.4kJ 的热量,该反应的热化学方程式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)生产中曾用铝热反应焊接钢轨,铝与氧化铁反应的化学方程式为___________。
(2)复方氢氧化铝治疗胃酸过多时,氢氧化铝表现______性;氢氧化铝的电离方程式_______________。
(3)铁、铝、铁铝合金三种物质中硬度最大的是_________________。
(4)铝锭能做成铝壶烧水,表现铝的导热性和______________,表面破损的铝制品,放久了破损处会有一层“白毛”产生,“白毛”既能溶于酸又能溶于碱溶液,写出形成“白毛”的化学方程式________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com