
| 组别 | 镁铝合金质量/g | HCl溶液体积/mL | 气体的体积/L |
| 甲 | 2.55 | 400 | 2.80 |
| 乙 | 3.85 | 400 | 3.36 |
| 丙 | 4.59 | 400 | 3.36 |
分析 HCl的物质的量一定,甲中合金质量小于乙中合金质量,且甲中生成气体体积小于乙中气体体积,说明甲中盐酸过量、金属完全反应.生成3.36L氢气需要合金的质量为2.55g×$\frac{3.36L}{2.80L}$$\frac{336mL}{280mL}$=3.06g<3.85g,故乙、丙中金属剩余,盐酸不足.
(1)丙中盐酸完全反应,根据氢原子守恒计算n(HCl),进而计算盐酸物质的量浓度;
(2)甲中盐酸有剩余,金属完全反应,设镁、铝的物质的量分别为xmol、ymol,根据二者质量、电子转移守恒列方程计算解答;
(3)在丙组实验之后向容器中加入1mol•L-1的氢氧化钠溶液,使剩余固体中无铝元素,最终溶液中溶质为NaCl、NaAlO2,根据钠离子守恒可知n(NaOH)=n(NaCl)+n(NaAlO2),结合氯离子守恒、Al原子守恒可知n(NaOH)=n(NaCl)+n(NaAlO2)=n(HCl)+n(Al),根据(2)中比例关系可计算丙中Al的物质的量,进而计算需要氢氧化钠溶液体积.
解答 解:HCl的物质的量一定,甲中合金质量小于乙中合金质量,且甲中生成气体体积小于乙中气体体积,说明甲中盐酸过量、金属完全反应.生成3.36L氢气需要合金的质量为2.55g×$\frac{3.36L}{2.80L}$$\frac{336mL}{280mL}$=3.06g<3.85g,故乙、丙中金属剩余,盐酸不足.
(1)丙中盐酸完全反应,生成氢气3.36L,氢气的物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,根据氢元素守恒可知:n(HCl)=2n(H2)=2×0.15mol=0.3mol,盐酸物质的量浓度为$\frac{0.3mol}{0.4L}$=0.75mol/L,
故答案为:0.75mol/L;
(2)甲中盐酸有剩余,金属完全反应,此时生成氢气2.80mL,故可以根据甲组数据计算金属的物质的量之比,设镁、铝的物质的量分别为xmol、ymol,根据二者质量可知:①24x+27y=2.55,根据电子转移守恒有:②2x+3y=$\frac{2.8L}{22.4L/mol}$×2,
根据①②联立解得:x=0.05、y=0.05,
所以合金中镁与铝的物质的量之比为:0.05mol:0.05mol=1:1,
故答案为:1:1;
(3)在丙组实验之后向容器中加入1mol•L-1的氢氧化钠溶液,使剩余固体中无铝元素,最终溶液中溶质为NaCl、NaAlO2,根据钠离子守恒可知n(NaOH)=n(NaCl)+n(NaAlO2),结合氯离子守恒、Al原子守恒可知n(NaOH)=n(NaCl)+n(NaAlO2)=n(HCl)+n(Al),
根据(2)中比例关系,可知丙中Al的物质的量为$\frac{4.59g}{24g/mol+27g/mol}$=0.09mol,
则n(NaOH)=n(NaCl)+n(NaAlO2)=n(HCl)+n(Al)=0.3mol+0.09mol=0.39mol,
故需要NaOH溶液体积为$\frac{0.39mol}{1mol/L}$=0.39L,
答:所加氢氧化钠溶液的体积为0.39L.
点评 本题考查混合物的计算,题目难度中等,根据表中数据关系判断反应的过量问题是关键,注意利用守恒思想解答,试题侧重考查学生的分析、理解能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
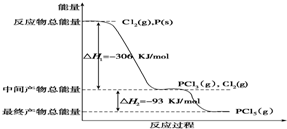
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4难溶于水,在水中离子浓度很小,所以BaSO4是弱电解质 | |
| B. | 在水溶液中能导电的化合物就是电解质 | |
| C. | H2SO4在电流作用下在水中电离出H+和SO42- | |
| D. | 液态HCl,固态NaCl均不导电,但HCl、NaCl是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
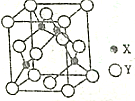 已知常见元素X的原子序数比常见元素Y的小,X的氢化物能与其最高价氧化物的水化物发生化合反应生成一种离子化合物M,Y元素的周期序数等于最外层电子数.回答下列问题:
已知常见元素X的原子序数比常见元素Y的小,X的氢化物能与其最高价氧化物的水化物发生化合反应生成一种离子化合物M,Y元素的周期序数等于最外层电子数.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,气体颜色加深,则此反应为吸热反应 | |
| B. | 慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅 | |
| C. | 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍 | |
| D. | 恒温恒容时,充入NO2气体,平衡向右移动,NO2的转化率增大,混合气体的颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b=0.2a | B. | b=0.3a | C. | b=0.25a | D. | a=2b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g NaCl | B. | 10g NaOH固体 | C. | 10g BaSO4固体 | D. | 10g AgNO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 事实 | 推论 |
| A | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
| B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
| C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
| D | HCl热稳定性比H2S强 | 非金属性:Cl>S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com