
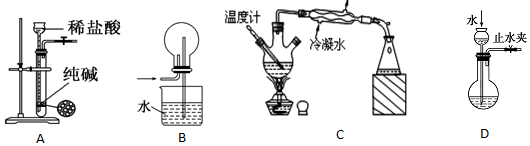
| A. | 用图A装置制取少量CO2气体 | |
| B. | 多余的NH3可用图B装置吸收 | |
| C. | 装置C可分离沸点不同且互溶的液体混合物 | |
| D. | 图D可检查装置的气密性 |
分析 A.盐酸易挥发,应该用分液漏斗盛放稀盐酸;
B.该装置中水易吸入圆底烧瓶中,不能用于吸收多余氨气;
C.温度计的水银球不能插入混合液,冷凝管的通水方向错误;
D.关闭止水夹,根据漏斗中水面变化可判断该装置气密性.
解答 解:A.用于盐酸具有挥发性,且无法控制加入稀盐酸的量,应该用分液漏斗盛放稀盐酸,故A错误;
B.氨气极易溶于水,吸收氨气的装置必须防止倒吸,该装置会发生倒吸现象,不能用于多余的NH3,故B错误;
C.该装置中温度计的水银球位置、冷凝管的通水方向都不合理,故C错误;
D.先关闭止水夹,向长颈漏斗中加入适量水,根据漏斗中水的变化情况可判断该装置的气密性,故D正确;
故选D.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及气体制备与吸收、装置气密性检查、混合物分离等知识,明确常见化学实验基本操作方法为解答关键,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | Fe (OH )3 溶于稀 H 2 SO4 中:H++OH-→H2O | |
| B. | 氨水滴入 AlCl 3 溶液中:Al3++3OH-→Al(OH)3↓ | |
| C. | FeO 溶于稀 HCl 中:O2-+2H+→H2O | |
| D. | 铝溶解在 NaOH 溶液中:2Al+2OH-+2H2O→2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发展循坏经济,构建资源节约型社会及开发清洁生产技术 | |
| B. | 用绿色化学生产工艺,建立环境友好型化工体系 | |
| C. | 大力开发可再生资源,推广使用乙醇汽油代替传统的燃油 | |
| D. | 设计化学实验方案时,提倡用尽可能多的样品和试剂以提高实验效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上可角电解法制备Mg:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+C12↑ | |
| B. | 用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O | |
| C. | 用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) | |
| D. | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2═2HClO+CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+2FeCl3═CuCl2+2FeCl2 | |
| B. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | |
| C. | Cl2+2KI═2KCl+I2 | |
| D. | 2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH2CH2OH | B. | CH2CH(OH)CH2OH | C. | CH2CH2OH | D. | HOCH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X+3Y?2Z,平衡常数为1600 | |
| C. | 其他条件不变时,增大压强可使平衡常数增大 | |
| D. | 改变温度可以改变该反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com