
 如图的实验装置用来分离CO2和CO气体并干燥.图中a为止水夹,b为分液漏斗的活塞,通过Y 型管和止水夹分别接c.d 两球胆,现装置内的空气已排尽.为使实验成功,甲、乙、丙分别盛放的溶液是( )
如图的实验装置用来分离CO2和CO气体并干燥.图中a为止水夹,b为分液漏斗的活塞,通过Y 型管和止水夹分别接c.d 两球胆,现装置内的空气已排尽.为使实验成功,甲、乙、丙分别盛放的溶液是( )| A. | 饱和NaHCO3 溶液、12mol•L-1盐酸、18.4mol•L-1H2SO4 | |
| B. | 饱和Na2CO3 溶液、2mol•L-1 H2SO4、饱和NaOH 溶液 | |
| C. | 饱和NaOH 溶液、2mol•L-1 H2SO4、18.4mol•L-1H2SO4 | |
| D. | 18.4mol•L-1H2SO4、饱和NaOH 溶液、18.4mol•L-1H2SO4 |
分析 CO2能与碱反应生成碳酸盐,可以先将CO2暂时除去,而CO一般不与任何物质反应且难溶于水,所以可以先分离出CO;然后将变成的碳酸盐加入适量稀酸再变成CO2,则可达到实验的目对CO2和CO混合气体进行分离.
解答 解:对于甲乙丙选择何种试剂,因为混合气体首先通过的是甲,由于CO2能与碱反应生成碳酸盐则剩余气体CO就很容易分离出,所以在甲中加入饱和NaOH溶液(饱和石灰水虽是碱但是对二氧化碳吸收能力有限),与CO2反应生成碳酸钠和水,CO通过乙瓶顺利分离出来,由于实验中含有水分所以乙中加入浓硫酸对其干燥;漏斗中丙液体是将生成的碳酸盐转变成CO2,所以应该装的是稀盐酸或者稀硫酸,
故选C.
点评 本题考查了气体混合物分离,注意混合物的分离是指用物理、化学方法将混合物中各组分分开,并恢复到原状态,得到比较纯的物质是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 373K时,某 2L密闭容器中加入2mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.
373K时,某 2L密闭容器中加入2mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O. _.
_. CH2OCH2CH2CHO B.
CH2OCH2CH2CHO B. CH=CHCH2CH2CHO
CH=CHCH2CH2CHO COOCH2CH2CH3
COOCH2CH2CH3查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氧化还原反应与放热反应属于包含关系 | |
| B. | 溶液与胶体属于并列关系 | |
| C. | 化合物与碱性氧化物属于交叉关系 | |
| D. | 化合物与电解质属于重叠关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2和N2O4的混合气体中,NO2的体积分数是80% | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0mol/L | |
| C. | 该合金中铜与镁的物质的量之比是2:1 | |
| D. | 得到2.54g沉淀时,加入NaOH溶液的体积是600mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
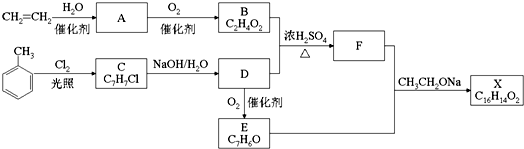
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O的热稳定性强于H2S | |
| B. | 硫化氢水溶液露置于空气中变浑浊 | |
| C. | H2O是液体,H2S常温下是气体 | |
| D. | 氧气和氢气化合比硫和氢气化合容易 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红棕色的NO2,加压后颜色先变深后变浅 | |
| B. | 高压比常压有利于合成SO3的反应 | |
| C. | 加入催化剂有利于氨的合成 | |
| D. | 升高温度,平衡向吸热方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com