
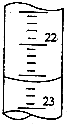
 用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 25.70 |
分析 (1)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器来解答;
(2)根据碱性溶液盛放在碱式滴定管中;
(3)先根据数据分析舍去误差太大的数据,再据C(待测)═$\frac{C(标准)×V(标准)}{V(待测)}$计算出C(待测);
(4)根据滴定管的结构和精确度读取.
解答 解:(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,故答案为:250mL容量瓶;
(2)待测液是碱性溶液,应盛放在碱式滴定管中,所以用碱式滴定管量取待测液注入锥形瓶中,
故答案为:碱式滴定管;
(3)第3次实验误差太大,所以V(标准)=[(20.40-0.50)+(24.10-4.00)]mL÷2=20.00mL,
则c(待测)=$\frac{C(标准)×V(标准)}{V(待测)}$=$\frac{0.2000mol/L×20.00mL}{10.00mL}$=0.4000mol•L-1,
故答案为:0.4000mol•L-1;
(4)滴定管精确到0.01ml,则滴定时的滴定管中的液面,其读数为22.60mL,故答案为:22.60.
点评 本题主要考查了中和滴定操作以及烧碱的浓度的计算,难度中等,注意知识的积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 1.5 |
| 完全沉淀时 | 4.7 | 2.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
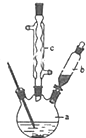 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱之一.下面是它的一种实验室合成路线: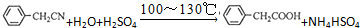

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
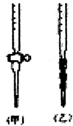 某学生为测定未知浓度的硫酸溶液,进行如下实验:用1.00mL待测硫酸溶液配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
某学生为测定未知浓度的硫酸溶液,进行如下实验:用1.00mL待测硫酸溶液配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 盐酸的体积(mL) | 标准NaOH溶液的体积(mL) |
| 1 | 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
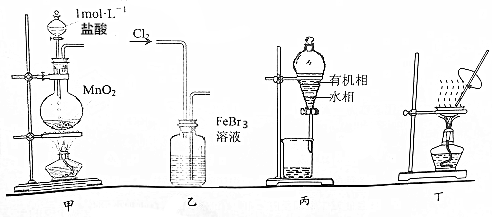
| A. | 用装置甲制取氯气 | |
| B. | 用装置乙氧化FeBr3溶液中的溴离子 | |
| C. | 用装置丙分液时先从下口放出水相,再从上口倒出有机相 | |
| D. | 用装置丁将分液后的水相蒸发至干,再灼烧制得无水FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该条件下,反应前后的压强之比为6:5.3 | |
| B. | 若反应开始时容器体积为2 L,则0~2 min内v(SO3)=0.35 mol/(L•min) | |
| C. | 在该条件下充入He气,各物质的反应速率都将增大 | |
| D. | 若反应改为“恒温恒容下”进行,放出Q kJ热量需要的时间将大于2 min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L Na2CO3溶液中的Na+ 数目为2NA | |
| B. | 标准状况下,11.2L CCl4所含分子数为0.5NA | |
| C. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.2NA | |
| D. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 英国道尔顿----提出元素概念 | |
| B. | 法国拉瓦锡----提出原子学说 | |
| C. | 俄国门捷列夫---发现元素周期律 | |
| D. | 英国波义耳----建立燃烧现象的氧化学说 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com