
早期发 现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成
现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成 。回答下列问题:
。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有 个未成对电子,三价铁离子的电子排布式为: 可用硫氰化钾检验三价铁离子,形成配合物的颜色为
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化 亚铜,乙醛中碳原子的杂化轨道类型为 ______;一摩尔乙醛分子中含有的σ键的数目为: 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
亚铜,乙醛中碳原子的杂化轨道类型为 ______;一摩尔乙醛分子中含有的σ键的数目为: 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为 。列式表示铝单质的密度 g·cm-3(不必计算出结果)
科目:高中化学 来源: 题型:
化学用语是学习化学的重要工具,下列化学用语中,正确的是
A.已知:2H2(g)+O2(g) = 2H2O(g) ΔH=-483.6 kJ/mol,氢气的燃烧热为241.8 k J/mol
J/mol
B.在AgCl悬浊液中加入KI溶液充分振荡:Ag+ + I- = AgI↓
C.某反应⊿H<0,ΔS>0,则该反应在任意条件下均可自发进行。
D.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁工业对促进经济和社会发展起了重要作用。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在________部分发生反应,在________部分开始生成生铁和炉渣。
(2)炼钢时,除磷的化学方程式为:_____________;
加入硅、锰和铝的目的是____________。
(3)不锈钢含有的 Cr 元素是在炼钢过程的氧吹________(填“前”或“后”)加入,原因是_________________。
(4)炼铁和炼钢生产中,尾气均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料)。
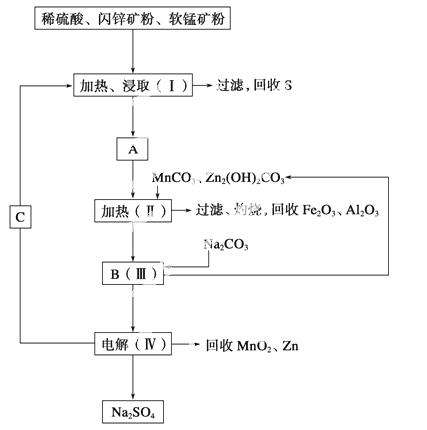
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
②Ⅳ中电解方程式为MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4。
MnO2+Zn+2H2SO4。
(1)A中属于还原产物的是______ ____。
____。
(2)加入MnCO3、Zn2(OH)2CO3的作用是_____________________________________
________________________________________________________________________。
Ⅱ需要加热的原因是____________________________________________________。
C的化学式是________________________。
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是________。
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是________。
(5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进行的操作有蒸发浓缩、________、过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
参考下表中物质的熔点,回答有关 问题:
问题:
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点/℃ | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 | SiCl4 | GeCl4 | SnCl4 | PbCl4 |
| 熔点/℃ | -90.4 | -70.4 | 5.2 | 120 | -70.4 | -49.5 | -36.2 | -15 |
(1)钠的卤化物及碱金属的氯化物的熔点与卤素离子及碱金属离子的________有关,随着________的增大,熔点依次降低。
(2)硅的卤化物的熔点及硅、锗、锡、铅的氯化物的熔点与________有关,随着________增大,________增大,故熔点依次升高。
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与________有关,因为_______________,
故前者的熔点远高于后者。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态Ni原子的价电子(外围电子)排布式为 ;
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 ;
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③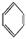 、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
(4)Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO FeO(填“<”或“>”);
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下图所示。该合金的化学式为 ;

查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
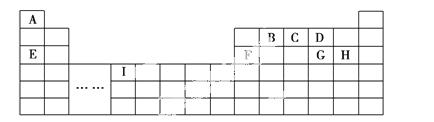
(1)写出由上述两种元素组成X2Y2型化合物的化学式分别为____________,其晶体类型分别为__________________。
(2)B、C、D的氢化物中,沸点最高的氢化物的结构式是____________,富含沸点最低的氢化物的矿物的名称是____________。
(3)上述元素形成的单质中,属于原子晶体的是________(填名称),其空间构型为________________。
(4)写出由上述元素中相同的四种元素组成的两种化合物的水溶液发生反应的离子方程式:_____________________。
(5)写出由上述元素中的三种形成的既含有离子键又含有极性共价键的化合物的电子式:____________________(任写两个)。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.25℃时,pH=13的氨水中含有OH-的数目为0.1NA
B.标准状况下,2.24 LNO2 与水反应生成NO3-的数目为0.1N A
A
C.1 mol Na被完全氧化生成Na2O2,转移电子的 数目为NA
数目为NA
D.4 .0 g H2与足量O2完全反应生成水,反应中断裂共价键的总数为2NA
.0 g H2与足量O2完全反应生成水,反应中断裂共价键的总数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com