
 如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )
如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是W>Y>Z | |
| B. | X的氢化物没有Z的氢化物稳定 | |
| C. | 常见的Y的氢化物具有正四面体结构 | |
| D. | Y的氢化物比W的氢化物沸点高,是因为分子间存在氢键 |
分析 根据元素在周期表中的位置知,X、Y、Z都是第二周期元素,W是第三周期元素,Y和W原子能形成两种造成酸雨的有害气体,同一主族能形成两种造成酸雨有害气体的元素是O、S元素,根据元素位置知Y是O元素、W是S元素,则X是N元素、Z是F元素,
A.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.元素的非金属性越强,其氢化物的稳定性越强;
C.Y的氢化物是水,为V形结构;
D.同一主族元素氢化物的沸点随着原子序数增大而增大,但含有氢键的氢化物熔沸点最高.
解答 解:根据元素在周期表中的位置知,X、Y、Z都是第二周期元素,W是第三周期元素,Y和W原子能形成两种造成酸雨的有害气体,同一主族能形成两种造成酸雨有害气体的元素是O、S元素,根据元素位置知Y是O元素、W是S元素,则X是N元素、Z是F元素,
A.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径大小顺序是W>Y>Z,故A正确;
B.元素的非金属性越强,其氢化物的稳定性越强,非金属性Z>X,所以氢化物的稳定性Z>X,故B正确;
C.Y的氢化物是水,水分子中O原子价层电子对个数是4且含有两个孤电子对,所以为V形结构,故C错误;
D.同一主族元素氢化物的沸点随着原子序数增大而增大,但含有氢键的氢化物熔沸点最高,Y、W位于同一主族,Y的氢化物中含有氢键,所以Y的氢化物比W的氢化物沸点高,故D正确;
故选C.
点评 本题考查原子结构和元素周期律,涉及元素周期律、微粒构型判断、氢键等知识点,为高考高频点,会利用价层电子对互斥理论确定微粒构型,知道氢键只影响物理性质不影响化学性质.


科目:高中化学 来源: 题型:选择题
| A. | 粗铜接电源的正极 | |
| B. | 电解一段时间后,溶液中Cu2+减小 | |
| C. | 若电路中通过1 mol电子,有0.5 mol铜被氧化 | |
| D. | 阴极反应只有Cu2++2e-→Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③ | B. | ④ | C. | ②⑤ | D. | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若R(OH)n为强碱,则W(OH)m也为强碱 | |
| B. | 若HnXOm为强酸,则Y是活泼非金属元素 | |
| C. | 若Y的最低化合价为-2,则Z的最高正化合价为+6 | |
| D. | 若X的最高正化合价为+5,则五种元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
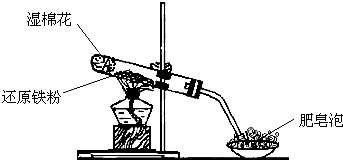
| 实验操作 | 预期的现象与结论 |
| 步骤1:取1-2mL上述溶液于试管甲中,向里面再滴入几滴KSCN溶液,振荡 | 有溶液变血红色现象,则证明有Fe3+,若无该现象,则证明不含Fe3+. |
| 步骤2:另取1-2mL上述溶液于试管乙中,向里面再滴入几滴KMnO4溶液,振荡 | 有KMnO4溶液紫色褪去现象,则证明有Fe2+,若无该现象,则证明不含Fe2+. |
| 步骤3:综合步骤1.2 | 得出结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com