
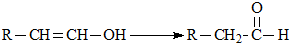 ��ѧʽΪC9H10O2���л���A�����µ�ת����ϵ
��ѧʽΪC9H10O2���л���A�����µ�ת����ϵ
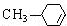 ��H��CH3COOCH=CH2
��H��CH3COOCH=CH2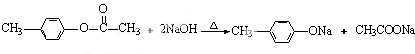
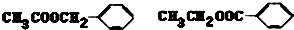 ��
�� ���� ��I�����Ӿ۷�Ӧ���ɣ�C4H6O2��n����֪I�ķ���ʽΪC4H6O2��I����������ˮ��Һ����������������B��D��B��������C��C���������Ʒ�Ӧ����D����IΪ����BΪȩ��DΪ�������Σ���B��C��D������ͬ��̼ԭ����ĿΪ2��I�IJ����Ͷ�Ϊ$\frac{2��4+2-6}{2}$=2����I�����л�����1��C=C˫������C�ṹ��ʽΪCH3COOH��BΪCH3CHO��CH2=CHOH���ȶ�����DΪCH3COONa��IΪCH3COOCH=CH2���л���A�ķ���ʽΪC9H10O2�������Ͷ�Ϊ$\frac{2��9+2-10}{2}$=5�����Ǻ��б�����A��NaOHˮ��Һ����������������D��E��E�ữ�õ�F����F��FeCl3��Һ�ܷ�����ɫ��Ӧ����F���з��ǻ�����A������������γɵ���������A�к���1��������1����������Ϸ���ʽ��֪��Ӧ��������������γɵ�������FΪ�����ӣ�F�����������ӳɷ�Ӧ����GΪ�����������л���Hֻ��һ�ֽṹ����ʹ��ˮ��ɫ��G������ȥ��Ӧ����H����F�м�����ǻ����ڶ�λ�����Ϸ�����֪��AΪ ����EΪ
����EΪ ��FΪ
��FΪ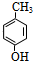 ��GΪ
��GΪ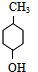 ��HΪ
��HΪ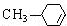 ���ݴ˷������
���ݴ˷������
��� �⣺��I�����Ӿ۷�Ӧ���ɣ�C4H6O2��n����֪I�ķ���ʽΪC4H6O2��I����������ˮ��Һ����������������B��D��B��������C��C���������Ʒ�Ӧ����D����IΪ����BΪȩ��DΪ�������Σ���B��C��D������ͬ��̼ԭ����ĿΪ2��I�IJ����Ͷ�Ϊ$\frac{2��4+2-6}{2}$=2����I�����л�����1��C=C˫������C�ṹ��ʽΪCH3COOH��BΪCH3CHO��CH2=CHOH���ȶ�����DΪCH3COONa��IΪCH3COOCH=CH2���л���A�ķ���ʽΪC9H10O2�������Ͷ�Ϊ$\frac{2��9+2-10}{2}$=5�����Ǻ��б�����A��NaOHˮ��Һ����������������D��E��E�ữ�õ�F����F��FeCl3��Һ�ܷ�����ɫ��Ӧ����F���з��ǻ�����A������������γɵ���������A�к���1��������1����������Ϸ���ʽ��֪��Ӧ��������������γɵ�������FΪ�����ӣ�F�����������ӳɷ�Ӧ����GΪ�����������л���Hֻ��һ�ֽṹ����ʹ��ˮ��ɫ��G������ȥ��Ӧ����H����F�м�����ǻ����ڶ�λ�����Ϸ�����֪��AΪ ����EΪ
����EΪ ��FΪ
��FΪ ��GΪ
��GΪ ��HΪ
��HΪ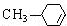 ��
��
��1��ͨ�����Ϸ���֪��BΪCH3CHO��HΪ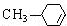 ��IΪCH3COOCH=CH2��
��IΪCH3COOCH=CH2��
�ʴ�Ϊ��CH3CHO��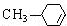 ��CH3COOCH=CH2��
��CH3COOCH=CH2��
��2��F��G�DZ��������������ӳɷ�Ӧ��G��H�Ǵ���������ȥ��Ӧ���ʴ�Ϊ���ӳɷ�Ӧ����ȥ��Ӧ��
��3��A��E+D�Ļ�ѧ��Ӧ����ʽΪ��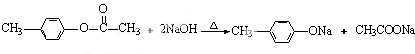 ��
��
�ʴ�Ϊ��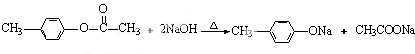 ��
��
��4��B��D�Ļ�ѧ����ʽΪCH3CHO+2Cu��OH��2+NaOH$\stackrel{��}{��}$2CH3COONa+Cu2O��+3H2O���ʴ�Ϊ��CH3CHO+2Cu��OH��2+NaOH$\stackrel{��}{��}$2CH3COONa+Cu2O��+3H2O��
��5����������������A�� ����ͬ���칹�壺��ֻ��һ�������ұ�����ֻ��һ��ȡ���������������࣬����Ϊ-OOCCH2CH3��-CH2OOCCH3��-CH2CH2OOCH��-CH��CH3��OOCH��-COOCH2CH3��-CH2COOCH3���ʹ���6�֣���������ͬ���칹��ṹ��ʽΪ
����ͬ���칹�壺��ֻ��һ�������ұ�����ֻ��һ��ȡ���������������࣬����Ϊ-OOCCH2CH3��-CH2OOCCH3��-CH2CH2OOCH��-CH��CH3��OOCH��-COOCH2CH3��-CH2COOCH3���ʹ���6�֣���������ͬ���칹��ṹ��ʽΪ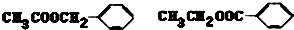 ���ʴ�Ϊ��6��
���ʴ�Ϊ��6�� ��
��
���� ���⿼���л����ƶϣ�Ϊ��Ƶ���㣬���ؿ���ѧ�������ƶϼ���ȡ��Ϣ������Ϣ���������������ȷ�����ż������ʹ�ϵ�ǽⱾ��ؼ���֪�������л�������ż������ʡ������л��ﷴӦ���ͼ���Ӧ�������ѵ���ͬ���칹�������жϣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ϡ��Ũ���ᣬӦ��ˮ����ע��ʢ��Ũ������ձ��в����� | |
| B�� | �ƾ��������ľƾ���һ�������Ż�Ӧ������ʪĨ���˸� | |
| C�� | ����Һմ��Ƥ���ϣ�Ӧ������Ĩ�����øɾ�����Ϳ��ϡ���� | |
| D�� | ������ԭ����ͭʵ�����ʱ��Ϊ��Լ������Ӧ��ֹͣ������ֹͣ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ��������A��C��B��D | B�� | ԭ�Ӱ뾶��B��D��C��A | ||
| C�� | ԭ��������C��B��D��A | D�� | �����Ӱ뾶��D��B��C��A |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��0.1mol•L-1�İ�ˮ�м���ͬ�����ˮ | |
| B�� | ��0.1mol•L-1��KOH��Һ�м���ͬ�����ˮ | |
| C�� | ��0.2mol•L-1�İ�ˮ�м���ͬ�����0.1mol•L-1���� | |
| D�� | ��0.2mol•L-1��KOH��Һ�м���ͬ�����0.1mol•L-1���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
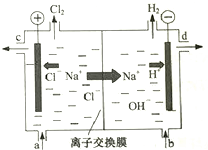 �ȼҵ�Ե�⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ���ȵĺ������ε�ϵ�л�����Ʒ����ͼ�����ӽ���Ĥ�����ʳ��ˮ��ʾ��ͼ��ͼ�е����ӽ���Ĥֻ����������ͨ�������������գ�
�ȼҵ�Ե�⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ���ȵĺ������ε�ϵ�л�����Ʒ����ͼ�����ӽ���Ĥ�����ʳ��ˮ��ʾ��ͼ��ͼ�е����ӽ���Ĥֻ����������ͨ�������������գ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na+��Al3+��OH-��Br- | B�� | H+��Fe2+��SO42-��CO32- | ||
| C�� | K+��NH4+��CO32-��OH- | D�� | Ca2+��Al3+��NO3-��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com