
分析 (1)高温条件下石灰石分解生成CaO,S和CaO、O2反应生成硫酸钙;
(2)二氧化硫属于酸性氧化物,能和弱碱氨水反应生成亚硫酸铵[(NH4)2SO3],强酸能和弱酸盐反应生成弱酸.
解答 解:(1)高温条件下石灰石分解生成CaO,S和CaO、O2反应生成硫酸钙,从而降低二氧化硫的排放,减少污染,两步反应化学方程式分别为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、2CaO+2S+3O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4,
故答案为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;2CaO+2S+3O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4;
(2)二氧化硫属于酸性氧化物,能和弱碱氨水反应生成亚硫酸铵[(NH4)2SO3],强酸能和弱酸盐反应生成弱酸,两步离子方程式分别为SO2+2NH3.H2O=2NH4++SO32-、SO32-+2H+=SO2↑+H2O,
故答案为:SO2+2NH3.H2O=2NH4++SO32-;SO32-+2H+=SO2↑+H2O.
点评 本题考查化学方程式、离子方程式的书写,为高频考点,明确反应物、生成物及反应条件、离子方程式书写规则即可解答,注意:弱电解质在离子方程式中要写化学式.


科目:高中化学 来源: 题型:多选题
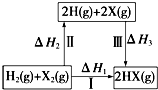
| A. | H2(g)+X2(g)═2H(g)+2X(g)△H2<0 | |
| B. | △H1=△H2+△H3 | |
| C. | 途径Ⅲ的按Cl、Br、I顺序依次增大 | |
| D. | 途径Ⅰ生成HCl比生成HBr的△H1小,说明HCl比HBr稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸能使湿润的蓝色石蕊试纸先变红后变黑 | |
| B. | 浓硫酸在常温下可迅速与铜片反应,放出二氧化硫气体 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 浓硫酸在常温下能使铁铝等金属钝化,加热条件下也不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 37gNH4F和16gCH4中含有的共价键数均为4NA | |
| B. | 0.51.4mol•L-1的NaHSO3溶液中含有的SO32-数为2NA | |
| C. | 标准状况下,16.8LNO2完全溶于水,转移电子数为0.5NA | |
| D. | 高温高压和催化剂条件下,密闭容器中2gH2与足量N2反应,转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+):②>④>③>① | B. | pH:②>③>④>① | ||
| C. | c(H+):①>③>②>④ | D. | c(NH3•H2O):②>④>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
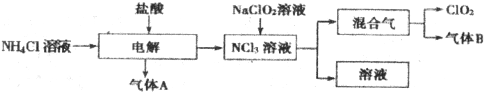
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com