
【题目】今年,雾霾阴影笼罩全国。二氧化硫、氮氧化物和可吸入颗粒物是雾霾的主要组成成分,综合治理其污染是环境化学当前的重要研究内容。
(1)汽车尾气中的 NO(g)和CO(g)在一定温度和催化剂的条件下可净化。发生的反应如下:2NO(g)+2CO(g)![]() 2CO2 (g)+N2 (g)
2CO2 (g)+N2 (g)
①已知:N2(g)+O2 (g)=2NO(g) ΔH=+180.0 kJ/mol。部分化学键的键能如下(键能指气态原子形成1mol化学键释放的最小能量)
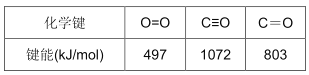
则反应:2NO(g)+2CO(g)![]() 2CO2 (g)+N2 (g) ΔH=__________ kJ/mol
2CO2 (g)+N2 (g) ΔH=__________ kJ/mol
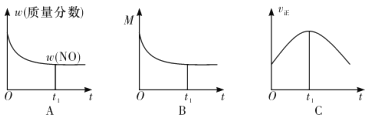
②若上述反应在绝热、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图不符合题意的是__________(填选项序号)。(图中 ω、M、v 正 分别表示质量分数、混合气体平均相对分子质量、正反应速率)
(2)尾气中的SO2可先催化氧化生成SO3,再合成硫酸。已知:2SO2(g)+O2 (g)![]() 2SO3(g) ΔH=-196.0 kJ/mol。
2SO3(g) ΔH=-196.0 kJ/mol。
①在一定温度的密闭容器中,SO2的转化率随时间的变化关系如图所示:
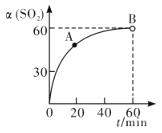
则A点的v逆(SO2 )__________(填―大于‖、―小于‖或―等于‖)B 点的 v正(SO2)。
②在某温度时,向10L的密闭容器中加入4.0 molSO2和10.0 molO2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是______(填选项序号)。
A.在其他条件不变时,减小容器的容积
B.保持温度和容器内压强不变,再充入2.0 mol SO2和5.0 mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍
(3)利用电化学原理,将NO2、O2和熔融KNO3 制成燃料电池,其原理如下图所示。
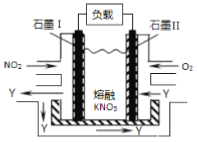
该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用。石墨Ⅱ是电池的____极,石墨Ⅰ附近发生的电极反应式为________________________。相同条件下,消耗的O2和NO2的体积比为_____。
(4)尾气中氮氧化物(NO和NO2 )也可用尿素[CO(NH2)2 ]溶液除去,反应生成对大气无污染的气体。1 mol 尿素能吸收工业尾气中氮氧化物(假设 NO、NO2体积比为 1∶1)的质量为___________g。
【答案】(1) ①-751.0; ②BC;
(2) ①小于;②BC ;
(3) ① 正; ②NO2+ NO3- - e - = N2O5; ③1︰4;(4) 76;
【解析】
试题分析:(1)①化学反应的实质是旧化学键的断裂和新化学键的形成。根据题中给出的部分化学键的键能可得:2CO(g)+O2(g)=CO2(g) ΔH=(2×1072+497)-4×803=-571 kJ/mol,又已知 N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ/mol,根据盖斯定律可知:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-571.0kJ/mol– (+180.0kJ/mol)= -751.0kJ/mol;
2CO2(g)+N2(g) ΔH=-571.0kJ/mol– (+180.0kJ/mol)= -751.0kJ/mol;
②根据①的结论,正反应为放热反应。在绝热、恒容的密闭体系中,随着反应的进行,反应物不断消耗,NO 的浓度逐渐减小,平衡时NO的质量分数保持不变,A 图正确;该反应的正反应气体分子数减小,随着反应的进行,气体总的物质的量减小,根据 M=m/n 可知混合气体的平均摩尔质量(M)逐渐增大,平衡后 M 不再变化,B 图错;随着反应的进行,从温度来看,温度不断升高,反应速率加快,从反应物的浓度来看,反应物不断消耗,反应速率减小,C 图中在 t1 时刻,正反应速率达到最大值,说明 t1 时刻之前反应速率主要受温度影响,t1 时刻之后随着反应物浓度的减小,正反应速率逐渐减小,直至达到平衡,所以 t1 时刻不是化学平衡时刻,C 图错。故选项 B、C 符合题意。
(2)①在一定温度的密闭容器中,SO2的转化率随时间的变化而增大,由图像可知,A 点过后,SO2的转化率任然增大,说明平衡正向移动,则A点时v逆(SO2)小于v正(SO2),B点时可逆反应达到平衡,则 B 点时v逆(SO2)等于B点的v正(SO2),而B点时v逆(SO2)大于A点时v逆(SO2)(平衡正向移动,逆反应速率逐渐增大),故A点的 v逆(SO2)小于B点的v正(SO2)。
②A.在其他条件不变时,减小容器的容积,氧气的浓度增大,虽然平衡正向移动,但是达到新的平衡,氧气的浓度仍比原来的浓度大,A 项不选;B.保持温度和容器内压强不变,再充入 2.0 mol SO 2 和 5.0 mol O 2 与原平衡属于等效平衡状态,浓度不变,B 项正确;C.保持温度和容器体积不变,再充入 SO2 和 SO3 ,使之浓度扩大为原来的两倍,根据Q=[2c(SO3)]2÷{[2c(SO2)]2×c(O2 )}= [c(SO3 )]2÷{[c(SO2)]2×c(O2)}=K,平移不移动,氧气的浓度不变,C 项正确;故选项 B、C 符合题意。
(3)利用电化学原理,将 NO2、O2和熔融 KNO 3 制成燃料电池,其总反应方程式为:4NO2 +O2=2N2O5,根据原理示意图可知,石墨Ⅱ(通入O2的电极)为正极;硝化剂 Y(Y 是一种氧化物)为 N2O5,熔融电解质中的NO3 - 向负极(石墨Ⅰ)移动,故 NO2、NO3-在负极反应生成N2O5 ,其电极反应方程式为NO2+ NO3-- e- = N2O5。
(4)由题目信息可知,NO、NO2与尿素[CO(NH2)2]反应生成 CO2、N2和 H2O,其反应方程式为 NO+NO2+CO(NH2)2 = CO2↑+2N2↑+2H2O,所以:
(NO+NO2) ~ CO(NH2)2
(30+46)g 1mol
故1mol尿素能吸收工业尾气中氮氧化物(假设 NO、NO2体积比为 1∶1)的质量为76g。


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】近年来各国都在寻找对环境无害而作用快速的消毒剂,其中二氧化氯(ClO2)是目前国际上倍受瞩目的第四代高效、无毒的消毒剂。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某兴趣小组的学生设计了如下模拟装置来制取、收集ClO2并测定其质量。
查阅资料:ClO2是一种黄红色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,温度过高可能引起爆炸,易溶于水,易与碱液反应。


实验Ⅰ:制取并收集ClO2,如图1装置所示。
(1)装置A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式__________。
(2)装置A必须添加温度控制装置,其温度要保持在60~80℃之间,控制温度的目的是__________。装置B也必须添加温度控制装置,应该是__________(填“冰水浴”或“沸水浴”或“60℃的热水浴”)装置。
实验Ⅱ:测定ClO2质量,如图2装置所示。过程如下:
在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;按照图2组装好仪器;在玻璃液封管中加入水,浸没导管口;将生成的ClO2气体由导管通入锥形瓶的溶液中充分吸收后,把玻璃液封管中的水封液倒入锥形瓶中,再向锥形瓶中加入几滴淀粉溶液:用cmol/L硫代硫酸钠标准液滴定锥形瓶中的液体,共用去VmL硫代硫酸钠溶液(己知:I2+2S2O32-=2I-+S4O62-)。
(3)装置中玻璃液封管的作用是____________________。
(4)滴定终点的现象是____________________。
(5)测得通入ClO2的质量m(ClO2)=__________g(用整理过的含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:

沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是 。调pH步骤中加入的试剂最好是 (填化学式)。实验室进行过滤操作所用到的玻璃仪器有 、 、 。
(2)煮沸CuSO4溶液的原因是 。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式 。
(3)Fe3+发生水解反应Fe3++3H2O![]() Fe(OH)3+3H+,该反应的平衡常数表达式为 。
Fe(OH)3+3H+,该反应的平衡常数表达式为 。
(4)称取所制备的CuCl样品0.250 0 g置于一定量的0.5 mol·L-1FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.100 0 mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00 mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乳酸的结构简式为 。试回答:
。试回答:
(1)乳酸分子中含有________和_________两种官能团(写名称)。
(2)乳酸与金属钠反应的化学方程式为______________________________________________。
(3)乳酸与Na2CO3溶液反应的化学方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近研究用生物质原料合成高分子材料PET的流程如下:
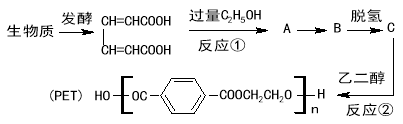
已知下列两个反应:
![]()
![]()
请回答下列问题:
(1)反应①属于 反应。
(2)PET的中文名称是 。
(3)有机物A、B的结构简式分别是 、 。
(4)写出反应②的化学方程式 。
(5)在有机物A的同分异构体F溶液中滴加氯化铁溶液显紫色。F的苯环上有四个取代基且一氯代物有只有一种,0.1molF 跟足量的金属钠反应,生成0.15mol氢气,F的核磁共振氢谱有4个吸收峰。试写出满足上述条件F的结构简式 (任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】I.无机物A是一种固体,熔点178℃,30℃以下为浅黄色。经测定A(相对分子质量为184)含两种元素,原子个数比为1:1。隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味。在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42g离子化合物D,D的水溶液的pH<7。已知气体C在标准状况下的密度为0.76g·L-1。
(1)A的化学式 ,C的电子式 。
(2)写出SCl2和气体C反应的化学方程式 。
Ⅱ.雾霾已经成为社会各界共同关注的热门话题,其中汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①该反应在低温下能自发进行,该反应的△H 0。(选填“>”、“<”)
②在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如右图所示(已知:t2-tl = t3-t2)。则下列说法不正确的是 。(填编号)

A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:tl~t2>t2~t3
(2)煤的综合利用有利于减少环境污染。合成氨工业原料气的来源之一水煤气法,在催化剂存在条件下有下列反应:
C(s)+H2O(g)![]() CO(g)+H2(g) △H1
CO(g)+H2(g) △H1
H2O(g)+CO(g)![]() CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
C(s)+2H2O(g)![]() CO2(g)+2H2(g) △H3
CO2(g)+2H2(g) △H3

①△H3和△H1、△H2的关系为△H3= 。
②在恒温条件下,将l mol CO和1 mol H2O(g)充入某固定容积的反应容器,达到平衡时有50%的CO转化为CO2。在tl时保持温度不变,再充入1 mol H2O(g),请在右图中画出tl时刻后H2的体积分数变化趋势曲线。(t2时刻重新达到平衡)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】
有机物A(C11H12O5)同时满足下列条件:①含苯环且不含甲基;②苯环上一氯取代物只有2种;③1 mol A与足量的NaHCO3反应生成1 mol CO2;④遇FeCl3溶液不显色。A有如图所示转化关系:

已知:
回答下列问题:
(1)A中有 种官能团,H的分子式为 。
(2)由C生成G的反应类型是 。
(3)G的结构简式为 ,K的结构简式为 。
(4)①写出C→D反应的化学方程式 ;
②写出I→J反应的离子方程式 。
(5)①C的同分异构体中能同时满足下列条件:a.能发生银镜反应,b.能发生皂化反应;c.能与Na反应产生H2气,共有 种(不含立体异构)。其中核磁共振氢谱显示为3组峰,且峰面积比为6﹕1﹕1的是 (写结构简式)。
②C的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是___________(填标号)。
A.元素分析仪 B.质谱仪 C.红外光谱仪 D.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——物质结构与性质】
氮及其化合物与人类生产、生活息息相关。回答下列问题:
(1)基态N原子中电子在2p轨道上的排布遵循的原则是________。前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为__________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是__________________________
(3)N2F2分子中N原子的杂化方式是___________________,l mol N2F2含有______mol![]() 键。
键。
(4)NF3的键角______NH3的键角(填“<”“>”或“=”),原因是__________________。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。l mol NH4BF4_________mol配位键。
(6)安全气囊的设计原理为6NaN3+FeIO3![]() Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑

①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质。写出两种与N3-互为等电子体的分子或离子____________。
②Na2O的晶胞结构如图所示,品胞边长为566pm,晶胞中氧原子的配位数为_____,Na2O晶体的密度为_____g·cm-3(只要求列算式,不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )

A. 由图甲知,A点SO2的平衡浓度为0.4 mol·L-1
B. 由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C. 达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D. 压强为0.50 MPa时,不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com