
【题目】在200 mL由NaCl、MgCl2、KCl组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
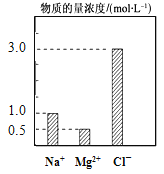
(1)该混合液中,NaCl的物质的量的浓度为 molL-1,含溶质MgCl2的物质的量为 mol。
(2)该混合液中KCl的质量为 g。
科目:高中化学 来源: 题型:
【题目】为了测定某盐酸的浓度,用0.2molL﹣1的碳酸钠标准液与该酸进行反应,为了准备480mL的标准液,某同学进行了下列操作(已乱序)
(1)①摇匀后,继续加蒸馏水至刻度线1cm处,改用胶头滴管加水至 止,然后盖上瓶塞,并振荡后倒入指定的试剂瓶内.
②向烧杯中注入约100mL水,在搅拌下很快溶解完.
③用自来水洗涤了烧杯3次,将洗涤液注入了废液缸内.
④将回温后的溶液沿玻璃棒注入 中. ⑤用天平称量 克碳酸钠粉末倒入了250mL的烧杯中.
(2)该同学操作正确的顺序是 (填编号)
(3)该同学的操作中步操作是错的(填编号),导致所配溶液的浓度 0.2molL﹣1 , (填=、>、<).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中有下列四组试剂,某同学欲分离含有氯化钾、氯化铁和硫酸钡的混合物,应选用的试剂组合是( )
A. 水、硝酸银溶液、稀硝酸 B. 水、氢氧化钾溶液、硫酸
C. 水、氢氧化钠溶液、稀盐酸 D. 水、氢氧化钾溶液、盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学方程式解释下列问题:
(1)实验室不用石英坩埚熔化NaOH固体: _________。
(2)漂白粉露置于空气中较长时间后失效: _________。
(3)Fe(OH)2暴露在空气中最后变成红褐色固体: _________。
(4)等物质的量的SO2与Cl2同时通入水中,溶液无漂白性:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图,回答下列问题:
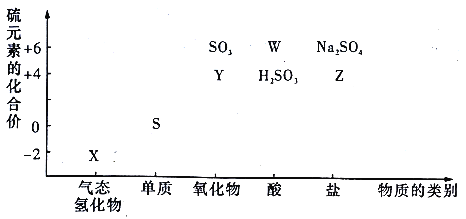
(1)检验Y所用的试剂是_________。
(2)W的稀溶液与铁反应的离子方程式为_________。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是_________(填标号)。
a.Na2S+S b.Na2SO3+S c.Na2SO3+Na2SO4 d.SO2+Na2SO4
(4)将X与Y的溶液混合,现象为_________,该反应的氧化剂与还原剂的物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产生活中广泛存在.
(1)处理生活污水中的NH4+ , 过程如图1: 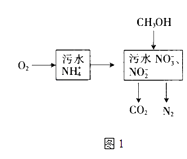
①根据较新的研究表明,将只含NO2﹣的污水与含NH4+的污水按比例混合,直接转化为无毒气体,该气体为 .
②空气将NH4+转变为NO3﹣或NO2﹣ , 溶液pH(填“增大”、“减小”或“不变”).
③完全处理含1mol NH4+污水,则n(O2)与n(CH3OH)关系式为[用n(O2)与n(CH3OH)表示].
(2)用焦炭还原NO2的反应为:2NO2(g)+2C(s )N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图2所示: 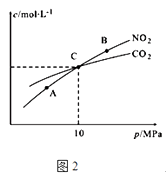
①A、B两点的浓度平衡常数关系:Kc(A)Kc(B) (填“>”、“<”或“﹦”).
②A、B、C三点中NO2的转化率最高的是(填“A”或“B”或“C”)点.
③计算C点时该反应的压强平衡常数Kp(C)=(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混和气体0.1mol完全燃烧得0.16摩尔CO2和3.6gH2O,下列说法正确的( )
A. 一定有乙烯B. 一定是甲烷和乙烯
C. 一定有乙炔D. 一定有甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρgcm-3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L.下列叙述中正确的是
①NH3属于电解质 ②NH3·H2O溶液具有丁达尔效应
③ω= ![]() ×100% ④c=
×100% ④c=![]()
⑤向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
A. ①③⑤ B. ②③⑤ C. ①②③④ D. 只有④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com