
| 2 |
| x |
 ,
, ;
;| 2 |
| x |
| 2 |
| x |


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
| A、用工业酒精(含甲醇)兑制饮用酒 |
| B、用食醋除去水壶内壁的水垢 |
| C、用甲醛水溶液浸泡海产品进行防腐保鲜 |
| D、在不通风、无防护的条件下用苯做实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某电源装置如图所示,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )
某电源装置如图所示,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )| A、正极反应为AgCl+e-═Ag+Cl- |
| B、放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C、若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D、当电路中转移0.01mol e-时,交换膜左则溶液中约减少0.02mol离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 | ||||
| B、核外电子排布相同的微粒化学性质也相同 | ||||
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)干冰是固态CO2的俗称,常用做人工降雨,22g干冰与A、B、C、D有如图所示的转化关系,请完成图中方框.
(1)干冰是固态CO2的俗称,常用做人工降雨,22g干冰与A、B、C、D有如图所示的转化关系,请完成图中方框.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
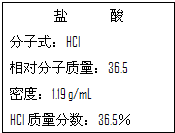 如图为实验室某浓盐酸试剂瓶标签上的有关数据,请根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,请根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
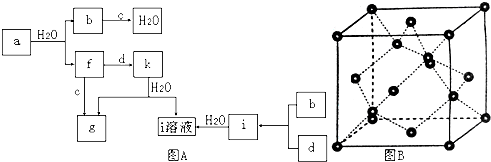
查看答案和解析>>
科目:高中化学 来源: 题型:
 I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g)
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g)| 加热 |
| 催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com