
SO2、NO是大气污染物。吸收SO2 和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
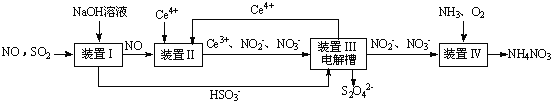
(1)装置Ⅰ中生成HSO3-的离子方程为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如右图所示。
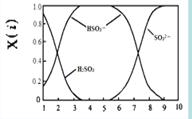
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
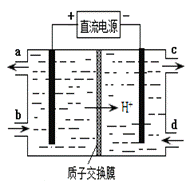
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
【知识点】无机流程、溶液中的离子浓度大小、电化学、计算
【答案解析】 (1)SO2 + OH-=== HSO3-(2分);
(2)①a、c (3分)
②HSO3- SO32-+H+,加入CaCl2溶液, Ca2++SO32-=== CaSO3↓使平衡右移,c(H+)增大。(3)NO+2H2O+3Ce4+===3Ce3++NO3-+4H+(3分)
SO32-+H+,加入CaCl2溶液, Ca2++SO32-=== CaSO3↓使平衡右移,c(H+)增大。(3)NO+2H2O+3Ce4+===3Ce3++NO3-+4H+(3分)
(4)①Ce3+- e-=== Ce4+ (2分) ② a (2分)
(5)243a(242a、244a、5600a /23都给分)(3分)
解析:(1)进入装置Ⅰ中的物质有:NaOH、NO、SO2,则生成HSO3-的离子方程为:
SO2 + OH-=== HSO3-
(2)①如图pH=8时,溶液中c(HSO3-) < c(SO32-)a正确。pH=7时,溶液中c(Na+)+c(H+) =c(HSO3-)+2c(SO32-)+c(OH-),c(H+)= c(OH-),所以b不正确。如图pH控制在4~5左右,溶液中没有HSO3-,所以c错。②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2原因为HSO3-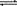 SO32-+H+,加入CaCl2溶液, Ca2++SO32-=== CaSO3↓使平衡右移,c(H+)增大。
SO32-+H+,加入CaCl2溶液, Ca2++SO32-=== CaSO3↓使平衡右移,c(H+)增大。
(3)装置Ⅱ中,如流程图反应物为NO、Ce4+生成物有Ce3+、NO3-。根据电荷守恒和题意给出酸性溶液,反应物还有H2O,生成物还有H+。根据氧化还原原理和得失电子守恒配平得NO+2H2O+3Ce4+===3Ce3++NO3-+4H+。
(4)①根据流程图其电极方程式只能是Ce3+- e-=Ce4+。②由Ce3+- e-= Ce4+得阳极生成Ce4+,所以从电解槽的a口流出。
(5)根据得失电子守恒NO2-和O2的物质的量之比为2:1。得氧气的体积为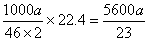 =243a 。
=243a 。
【思路点拨】本题考查了离子方式、电极方程式的书写,溶液中浓度大小的比较,氧化还原反应,利用电荷守恒计算。题目难度较大。注意从已知提取信息,培养看图分析能力。


科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.向盐酸中滴加氨水:H+ + OH- = H2O
B.Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
C.铜溶于稀硝酸:3Cu + 8H+ + 2NO3- = 3Cu2+ + 2 NO ↑+ 4H2O
D.CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
某校研究学习小组同学在实验时把SO2通入装有1mol/LBaCl2溶液的试管中,出现了白色浑浊物。
(1)实验小组的同学根据沉淀溶解平衡原理查阅了工具书上的相关数据,经过计算推导得出:常温下即使把SO2通入1mol/L BaCl2溶液中至饱和,也不可能生成BaSO3沉淀,故白色浑浊物只能是BaSO4。你认为所查阅的数据为: 。
(2)二氧化硫通入氯化钡溶液中理论上不产生沉淀,而实际受到空气和溶液中氧气的影响很快便能观察到沉淀现象.为了避免产生沉淀,某化学小组设计了如下实验装置,实验操作步骤如下:
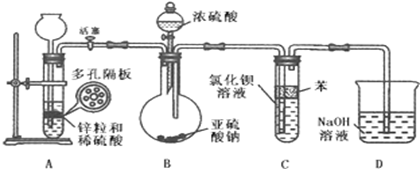
①气密性检查完好后,在装置A中的多孔隔板上放上锌粒,通过 全【品教学网, 用后离不了!注入稀硫酸.打开活塞,将产生的氢气导入到后续装置.
②D中气泡均匀冒出并验纯全【品教学网, 用后离不了!后关闭活塞,将装置D的导管插入烧杯中。
③通过装置B的 全【品教学网, 用后离不了!滴加浓硫酸,产生的气体进入到BaCl2溶液中,溶液保持澄清。
④打开活塞,将产生的氢气导入后续装置一段时间。
⑤将盛有BaCl2溶液的试管从装置中取出,拔去橡皮塞用胶头滴管伸入到苯层下方滴加双氧水,随即出现白色浑浊,滴加稀盐酸并振荡,白色浑浊不消失。
⑥拆卸装置,清洗仪器,处理剩余药品。
请回答下列问题
(2)实验步骤①和③的空白处使用的仪器名称分别为 、 全【品教学网, 用后离不了!;
(3)反应开始前,先向制取SO2的装置中通入纯净的A中产生的氢气,其作用是: 。
(4)装置C中苯的作用是 。
(5)装置D的目的是 全【品教学网, 用后离不了!
(6)写出实验步骤⑤试管中发生反应的化学方程式 、 全【品教学网, 用后离不了!;
查看答案和解析>>
科目:高中化学 来源: 题型:
下列操作中,完全正确的一组是
①用试管夹夹持试管时,试管夹从试管底部上套,夹在试管的中上部
②给盛有液体的体积超过1/3容积的试管加热
③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤取用放在细口瓶的液体时,取下瓶塞倒立放桌面上,倾倒液体时,瓶上的标签对着地面
⑥将烧瓶放在桌上,用力塞紧塞子 ⑦用坩埚钳夹取加热后的蒸发皿
⑧将滴管垂直伸进试管内滴加液体 ⑨稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中
⑩检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热
A.①④⑦⑩ B.②③④⑩ C.⑤⑥⑦⑧ D.①②⑥⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
某工业废水仅含下表中的某些离子,且各种离子
的物质的量浓度相等,均为0.1mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ |
| 阴离子 | C1- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ、取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是 。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是 。
(3)甲同学最终确定原溶液中所含阳离子有 ,阴离子有 ;并据此推测原溶液应该呈 性,原因是 (请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为 。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,所采取的分离方法与对应原理都正确的是
| 选项 | 目的 | 分离方法 | 原理 |
| A. | 分离溶于水的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B. | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C. | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
| D. | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)是目前国际上公认的第四代高效、
无毒的消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1) ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是________。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,其流程如下:
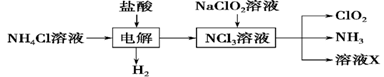
(2) 写出电解时发生反应的化学方程式:____________。
(3) 除去ClO2中的NH3可选用的试剂是________。(填序号)
A.饱和食盐水 B.碱石灰
C.浓硫酸 D.水
(4) 测定ClO2(如右图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,
再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol·L-1硫代硫酸钠标准溶液滴定(I2+2S2O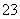 = 2I-+S4O
= 2I-+S4O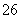 ),共用去V mL硫代硫酸钠溶液。
),共用去V mL硫代硫酸钠溶液。
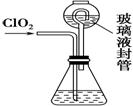
①装置中玻璃液封管的作用是_______________________________________。
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式__________________。
③滴定终点的现象是________________________________________________。
④测得通入ClO2的质量m(ClO2)=________。(用含c、V的代数式表示)
(5) 用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO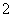
2001年我国卫生部规定,饮用水的ClO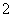 含量应不超过0.2 mg·L-1。若饮用水中ClO
含量应不超过0.2 mg·L-1。若饮用水中ClO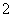 的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
普通玻璃、钢铁和玻璃钢是三种不同的材料,它们在性能方面差别很大。请根据学过的知识,回答下面问题。
(1)普通玻璃的成分是____________________________________________。
(2)铁在人类的生产和生活中有着十分重要的应用。铁的应用,经历了________到________到________的演变过程。
(3)某种复合材料具有耐高温、强度高、导电性好、导热性好的特点,估计该复合材料的基体和增强体材料可能分别是( )
A.金属;碳纤维 B.陶瓷;SiO2
C.合成树脂;SiO2、Al2O3、MgO D.合成树脂;碳纤维
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com