
【题目】一定温度下,在固定容积的密闭容器中,可逆反应:mA(g)+nB(g)![]() pCg)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vA:vB:vC:vD=m:n:p:q,其中,能说明反应已达到平衡的是( )
pCg)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vA:vB:vC:vD=m:n:p:q,其中,能说明反应已达到平衡的是( )
A.只有③④B.②③④C.①②③④D.①②③④⑤
【答案】A
【解析】
根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
①如果两边的化学计量数之和相等,体系的压强始终不变,所以不一定平衡,故不符合题意;
②容积恒定,所以容器内气体密度一直不变,则体系的密度不再发生变化,不一定是平衡状态,故不符合题意;
③各组分的物质的量浓度不再改变,说明各物质的量不变,反应达平衡状态,故符合题意;
④各组分的质量分数不再改变,说明各物质的质量不变,反应达平衡状态,故符合题意;
⑤只要反应发生就有反应速率v(A):v(B):v(C):v(D)=m:n:p:q,所以不一 定是平衡状态,故不符合题意;
综上所述,答案为A。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】近年来,中国华北华中地区发生了严重的雾霾天气。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。已知:① 2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ/mol,② N2(g)+O2(g)
2CO2(g) ΔH=566.0 kJ/mol,② N2(g)+O2(g)![]() 2NO(g) ΔH=+180.5 kJ/mol,③ 2NO(g)+O2(g)
2NO(g) ΔH=+180.5 kJ/mol,③ 2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ/mol。 回答下列问题:
2NO2(g) ΔH=116.5 kJ/mol。 回答下列问题:
CO的燃烧热为________。CO将NO2还原为单质的热化学方程式为______________。
(2)改变煤的利用方式可减少环境污染,通常可将煤气化转化为水煤气,其反应原理为:C(s)+H2O(g) ![]() CO(g)+H2(g) ; △H=+131.3kJ/mol。
CO(g)+H2(g) ; △H=+131.3kJ/mol。
①该反应在_________下能自发进行(填“高温”或“低温”)。
②水煤气燃烧过程中产生的CO2气体可以与“84消毒液”的主要成分NaClO发生反应,该反应的离子方程式为:___________________________________________________。(已知:酸性HCO3-<HClO<H2CO3)
(3)已知反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | |
CO | H2O | H2 | |||
1 | 650 | 4 | 2 | 1.6 | 6 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 900 | a | b | c | t |
①实验1条件下平衡常数K=________________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是______。
③该反应的△H ____0(填填“小于”,“大于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正己烷是优良的有机溶剂,其某种模型如图所示。下列有关说法正确的是( )
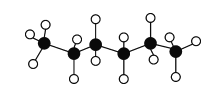
A.正己烷的分子式为![]()
B.正己烷的一氯代物有3种
C.正己烷能与溴水发生取代反应而使溴水褪色
D.正己烷中的所有碳原子位于同一条直线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,将1 mol A和2 mol B放入容积为5L的某密闭容器中发生如下反应:![]() ,经5min后,测得容器内B的浓度减少了
,经5min后,测得容器内B的浓度减少了![]() ,则下列叙述错误的是( )
,则下列叙述错误的是( )
A.在5 min内,该反应用C的浓度变化表示的反应速率为![]()
B.在5 min时,容器内D的浓度为![]()
C.该可逆反应未达限度前,随反应的进行,容器内压强逐渐增大
D.5 min时,容器内气体总的物质的量为3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料,现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
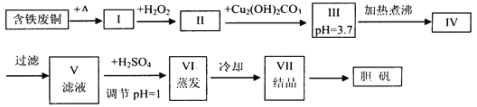
pH值控制可参考下列数据
物质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
氢氧化铁 | 2.7 | 3.7 |
氢氧化亚铁 | 7.6 | 9.6 |
氢氧化铜 | 5.2 | 6.4 |
请根据上述流程回答下列问题:
(1)A可选用__(填字母)
a.稀H2SO4 b.浓H2SO4、加热 c.浓FeCl3溶液 d.浓HNO3
(2)Ⅰ中加H2O2的目的__。
(3)Ⅱ中加Cu2(OH)2CO3的目的是__,其优点是__。
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为__。
(5)V中加H2SO4调节pH=1是为了__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11,下列说法正确的是
A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C.25°C时,Mg(OH)2固体在20mL 0.01 mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小
D.25°C时,在Mg(OH)2的悬浊液加入浓NaF溶液后,Mg(OH)2不可能转化成为MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其极强的爆炸性,又称为“盐粒炸弹”。科学家发现“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N原子排列成V形,如果5个N原子结合后都达到8电子结构,且含有2个氮氮叁键,则“N5”分子碎片所带电荷是_____,写出它的电子式________,1个“N5”正离子共有______个核外电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.1g镁铝合金溶于600mL0.5mol·L-1H2SO4溶液中,完全溶解后再加入1.0mol·L-1的NaOH溶液,得到沉淀的质量为13.6g,继续滴加NaOH溶液时则沉淀会减少。
(1)当加入__mLNaOH溶液时,可使溶解在硫酸中的Mg![]() 和Al
和Al![]() 恰好完全沉淀。
恰好完全沉淀。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积。(列出算式)___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,Y的原子半径是短周期主族元素中最大的,元素W的最外层电子数是次外层的2.5倍,元素X的最外层电子数是电子层数的3倍,元素Z的单质,通常为黄绿色气体,与Y的最高价氧化物的水化物反应的产物可作漂白剂和消毒剂。
(1)元素W、X、Y、Z的符号分别是______,______,______,______。
(2)实验中制备Z单质的反应方程式为 ________________________。
(3)Z单质与X的氢化物发生反应的化学方程式为 __________________ 。若将干燥的有色布条放入Z的单质中,观察到的现象是 ___________________,原因是__________。
(4)Z单质与Y的最高价氧化物的水化物反应的化学方程式是_______,该反应中2mol Z完全反应时转移电子的数目_______ NA。
(5)实验中制备W的氢化物的反应方程式为 _________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com