
| A. | NH4Cl与浓H2SO4混合共热,生成的气体用碱石灰进行干燥 | |
| B. | N2+3H2$?_{高温、高压}^{催化剂}$2NH3,用烧碱进行干燥 | |
| C. | 加热浓氨水,气体用碱石灰干燥 | |
| D. | 加热NH4HCO3,气体用P2O5干燥 |
分析 A.二者不反应得不到氨气;
B.N2与H2反应生成氨气需要高温高压催化剂条件,且此反应是可逆反应,在实验室中不能实现;
C.依据浓氨水易挥发的性质结合氨气为碱性气体的性质解答;
D.NH4HCO3受热生成氨气水二氧化碳,用P2O5干燥无法排除二氧化碳.
解答 解:A.NH4Cl和H2SO4(浓)混合加热得不到大量氨气,不能用来实验室制备,故A错误;
B.N2与H2反应生成氨气需要高温高压催化剂条件,且此反应是可逆反应,反应条件复杂,得到的产物不纯净,在实验室中不能实现,故B错误;
C.浓氨水具有挥发性,加热能够促进氨气的挥发,氨气为碱性气体,应选择碱性干燥剂干燥,可以用碱石灰干燥,故C正确;
D.碳酸氢铵(NH4HCO3)受热分解,生成氨气(NH3)、二氧化碳和水,反应的化学方程式为:NH4HCO3
| ||
点评 本题考查了实验室制备氨气的反应原理和干燥试剂选择,熟悉相关物质的性质是解题关键,题目难度不大.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
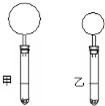 右下图是10mLpH均为2的盐酸和醋酸分别与足量的碳酸钙完全反应后,所观察到的实验现象(反应过程中产生的气体全部收集在试管上部的气球中).下列说法不正确的是( )
右下图是10mLpH均为2的盐酸和醋酸分别与足量的碳酸钙完全反应后,所观察到的实验现象(反应过程中产生的气体全部收集在试管上部的气球中).下列说法不正确的是( )| A. | 乙试管中盛放的是盐酸溶液 | |
| B. | 甲试管中盛放的是醋酸溶液 | |
| C. | 反应开始时的速率:甲>乙 | |
| D. | 反应结束时消耗碳酸钙的质量:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
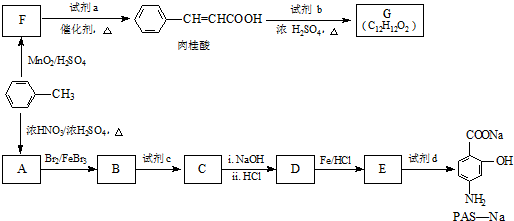
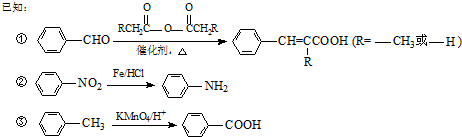
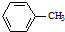 生成A的反应类型是取代反应.
生成A的反应类型是取代反应.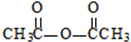 .
.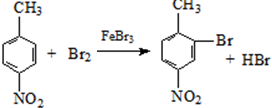 .
.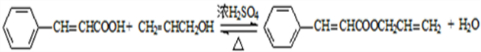 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
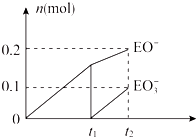 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | K闭合时,c电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42- | |
| B. | 当电路中转移0.4mol电子时,I中消耗的H2SO4为0.2 mol | |
| C. | K闭合时,II中SO42-向c电极迁移 | |
| D. | K闭合一段时间后,II可单独作为电源,d电极为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
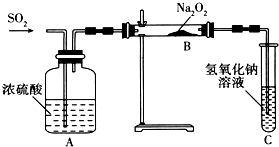
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向AgNO3溶液中加入过量氨水 | 由白色沉淀生成 | Ag+与NH3•H2O不能共存 |
| B | 向2ml2%的CuSO4溶液中加入0.5mol/L的NaOH溶液,震荡后低价几滴M溶液,加热 | 未出现砖红的沉淀 | M不属于醛类物质 |
| C | 向NaAlO2溶液中滴加饱和NaHCO3溶液 | 由白色沉淀生成 | 验证两者都发生了水解反应,且相互促进 |
| D | 向草酸溶液中低价几滴紫色酸性KmnO4溶液,震荡 | 溶液紫色褪去 | 草酸具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
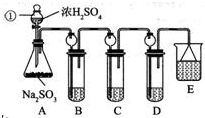
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com