
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ���� (����)
A. FeO����ϡ����:FeO+2H+ ![]() Fe2++H2O
Fe2++H2O
B. Al2(SO4)3��Һ�м������Ba(OH)2��Һ:Al3++4OH- ![]() AlO2-+2H2O
AlO2-+2H2O
C. Ư����Һ��ͨ������CO2: 2ClO-+H2O+CO2![]() 2HClO+CO32-
2HClO+CO32-
D. ��NaOH��Һ�еμӹ���Ca(HCO3)2��Һ:Ca2++HCO3-+OH-![]() CaCO3��+H2O
CaCO3��+H2O
���𰸡�D
��������
A�FeO����ϡ����ʱ��FeO��������Fe3+������NO�������ӷ���ʽΪ��3FeO+10H++NO3-=3Fe3++NO��+5H2O����A�����
B�Al2(SO4)3��Һ�м������Ba(OH)2��Һ������ƫ�����κ����ᱵ�����������ӷ���ʽΪ2Al3++3SO42-+3Ba2++8OH-=2AlO2-+4H2O+3BaSO4������B�����
C�Ư�۵���Ч�ɷ���Ca(ClO)2��Ư����Һ��ͨ������CO2�����ӷ���ʽΪ��Ca2++2ClO-+ H2O+ CO2=2HClO+CaCO3������C�������
D���NaOH��Һ�еμӹ���Ca(HCO3)2��Һ����̼��ơ�̼�����ƺ�ˮ����Ӧ�����ӷ���ʽΪCa2++ HCO3��+ OH����CaCO3��+ H2O����D����ȷ��
����������������ȷ��ΪD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У���һ����̼��ˮ����������������ȣ��ڴ��������·�����Ӧ��CO��g����H2O��g��![]() H2��g����CO2��g������500 ��ʱ��ƽ�ⳣ��K��9������Ӧ��ʼʱ��һ����̼��ˮ������Ũ�ȶ���0.02 mol/L�����ڴ�������CO��ת����Ϊ�� ��
H2��g����CO2��g������500 ��ʱ��ƽ�ⳣ��K��9������Ӧ��ʼʱ��һ����̼��ˮ������Ũ�ȶ���0.02 mol/L�����ڴ�������CO��ת����Ϊ�� ��
A. 25% B. 50% C. 75% D. 80%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ��Cl2��������������Cl2+SO2+2H2O��2HCl+H2SO4����ͼ���йض����������ʵ�ʵ��װ��ͼ���Իش��������⣺
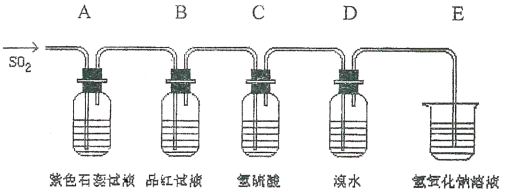
(1)A��B��C��D�ĸ�װ���з���������������_________��________��_________��_________��
(2)����������У�(1)Ư���� (2)��������������� (3)��ԭ�� (4)�����ԡ�����ͼ����װ���ж�Ӧ���ֳ���������(�����)A��_____B��____C��______D��______��
(3)ʵ����Ϻ�ȡ����D����Һ���Թ��У�����BaCl2��Һ��ϡ���ᣬ������_______________��
(4)E�з�����Ӧ�Ļ�ѧ����ʽΪ_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. �Ҵ�(CH3CH2OH)�������(CH3-O-CH3)��Ϊͬ���칹��
B. C2H4 ��C3H6һ����Ϊͬϵ��
C. ![]() ��������������
��������������
D. �ǻ��ĵ���ʽΪ![]() ��1 mol ��OH ����7 mol ����
��1 mol ��OH ����7 mol ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(N2H4)�ǻ����������һ��ȼ�ϣ���ӦʱN2O4Ϊ������������N2��ˮ��������֪��N2(g)+2O2(g)====N2O4(g) ��H="+8.7" kJ��mol-1
N2H4(g)+O2(g) ====N2(g)+2H2O(g) ��H="-534.0" kJ��mol-1
���б�ʾ�¸�N2O4��Ӧ���Ȼ�ѧ����ʽ����ȷ���ǣ� ��
A. 2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g)��H="-542.7" kJ��mol-1
B. 2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g)��H="-1" 059.3 kJ��mol-1
C. N2H4(g)+1/2 N2O4(g) ====3/2N2(g)+2H2O(g)��H="-1" 076.7 kJ��mol-1
D. 2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g)��H="-1" 076.7kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���� (����)��
A. ���в���ֶ�ֻ���н���Ԫ��
B. �ҹ���ͨ��Ӳ�Ҳ����ǽ�������
C. �㶫���̵����������ϴ��ڴ������Ʋ;�
D. þ�Ͻ��Ӳ�Ⱥ�ǿ�Ⱦ����ڴ�þ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ĸ���ͬ���ܱ������У����ò�ͬ�������з�ӦN2(g)+3H2(g)![]() 2NH3(g)��������������ͬʱ���ڲⶨ�Ľ���жϣ����ɰ�������������
2NH3(g)��������������ͬʱ���ڲⶨ�Ľ���жϣ����ɰ�������������
A. v(N2)=0.2mol/(Lmin)B. v(NH3)=0.3mol/(Lmin)
C. v(H2)=0.1mol/(Lmin)D. v(H2)=0.3mol/(Lmin)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����������˵������ȷ���ǣ� ��
A.53g̼�����к�NA��CO32-
B.0.1molOH-��NA������
C.1.8g��ˮ(D2O)�к�NA������
D.��״����11.2L SO3�к�NA����ԭ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com