
 原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,C与D同主族相邻;E的最外层只有1个电子,但次外层有18个电子;F位于周期表的ds区,最外层有2个电子.
原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,C与D同主族相邻;E的最外层只有1个电子,但次外层有18个电子;F位于周期表的ds区,最外层有2个电子.分析 原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故A为碳元素;E的最外层只有1个电子,但次外层有18个电子,则E为Cu,F位于周期表的ds区,最外层有2个电子,则F为Zn;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,核外电子排布为1s22s22p4故,故C为O元素;C与D同主族相邻,则D为S元素.B的原子序数介于碳、氧之间,所以B为N元素.
(1)Cu处于第四周期IB族,Cu2+的价电子排布中3d轨道有9个电子;
(2)D为S元素,处于周期表中第四周期VIA族;
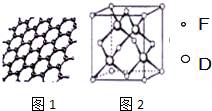
(3)每个环上含有6个原子,而没个原子为3个环共用;
(4)化合物CO2分子为直线形结构,碳原子采取sp杂化;
(5)KMnO4酸性溶液吸收SO2气体时,MnO4-被还原为Mn2+,SO2被氧化为SO42-,根据元素守恒和电荷守恒书写;
(6)计算1mol碳完全燃烧生成二氧化碳放出的热量,注明物质的聚集状态与反应热书写热化学方程式;
(7)氧与Cu形成一种红色化合物X为Cu2O,Cu2O溶解于稀硫酸得到一种红色固体单质和蓝色溶液,即反应生成Cu与硫酸铜;
(8)根据均摊法计算晶胞中Zn、S原子数目,进而确定化学式,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算.
解答 解:原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故A为碳元素;E的最外层只有1个电子,但次外层有18个电子,则E为Cu,F位于周期表的ds区,最外层有2个电子,则F为Zn;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,核外电子排布为1s22s22p4故,故C为O元素;C与D同主族相邻,则D为S元素.B的原子序数介于碳、氧之间,所以B为N元素.
(1)Cu处于第四周期IB族,Cu2+的价电子排布中3d轨道有9个电子,价电子排布式为:3d9,
故答案为:3d9;
(2)D为S元素,处于周期表中第四周期VIA族,
故答案为:第四周期VIA族;
(3)每个环上含有6个原子,而没个原子为3个环共用,则其中一个最小环占有A原子为6×$\frac{1}{3}$=2 个,
故答案为:2;
(4)化合物CO2分子为直线形结构,碳原子采取sp杂化,为对称性结构,属于非极性分子,
故答案为:sp;非极性;
(5)KMnO4酸性溶液吸收SO2气体时,MnO4-被还原为Mn2+,SO2被氧化为SO42-,该反应的离子方程式为5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+,
故答案为:5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+;
(6)1mol碳完全燃烧生成二氧化碳放出的热量为a kJ×$\frac{1mol×12g/mol}{1g}$=12a kJ,碳单质燃烧热的热化学方程式为:C(s)+O2(g)=CO2(g)△H=-12a kJ/mol,
故答案为:C(s)+O2(g)=CO2(g)△H=-12a kJ/mol;
(7)氧与Cu形成一种红色化合物X为Cu2O,Cu2O溶解于稀硫酸得到一种红色固体单质和蓝色溶液,即反应生成Cu与硫酸铜,该反应的离子方程式为:Cu2O+2H+=Cu+Cu2++H2O,
故答案为:Cu2O+2H+=Cu+Cu2++H2O;
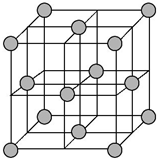
(8)S与Zn形成化合物的晶胞中,S在晶胞内部,原子数为4,Zn在顶点和面心,Zn的原子数为$\frac{1}{8}$×8+$\frac{1}{2}$×6=4,所以其化学式为ZnS,
晶胞的质量为$\frac{4×97}{{N}_{A}}$g,晶胞边长为a nm,则晶胞的体积为(a×10-7 cm)3,所以晶体的密度为ρ=$\frac{4×97}{{N}_{A}}$g÷(a×10-7 cm)3=$\frac{388}{{N}_{A}×(a×1{0}^{-7})^{3}}$g/cm3,
故答案为:ZnS;$\frac{388}{{N}_{A}×(a×1{0}^{-7})^{3}}$.
点评 本题考查物质结构和性质,涉及核外电子排布、晶胞计算、分子结构、杂化轨道、氧化还原反应、热化学方程式书写等,需要学生具备扎实的基础与灵活运用能力.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
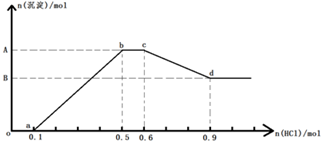
| A. | 原溶液中n(Na+)=0.6mol | B. | 原溶液中n(AlO2-)=0.3mol | ||
| C. | A点对应的沉淀物质的量为0.2mol | D. | bc段的反应为:CO32-+H+=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 蛋白质中含有C、H、O、N、S等元素,食物中的铁主要以三价铁与蛋白质和羧酸结合成络合物的形式存在.
蛋白质中含有C、H、O、N、S等元素,食物中的铁主要以三价铁与蛋白质和羧酸结合成络合物的形式存在.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铁片为正极,碳棒为负极 | |
| B. | 碳棒附近的溶液可使酚酞变红 | |
| C. | 铁被腐蚀,碳棒上有氯气放出 | |
| D. | 导线上有电流通过,电流方向是由铁极流向碳极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com