
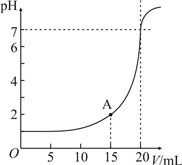
| 0.01L×0.1L/mol |
| 0.02L |
| 0.01L×0.1L/mol-0.015L×0.05mol/L |
| 0.025L |


科目:高中化学 来源: 题型:
 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)一定条件下,在容积为2L的密闭容器中加入一定量的A,发生如下反应并建立平衡:A(g)?2B(g) 2B(g)?2D(g)+C(g)测得平衡时各物质的浓度是:c(A)=0.3mol?L-1,c(B)=0.2mol?L-1,c(C)=0.05mol?L-1,则最初加入的A物质的量是
(1)一定条件下,在容积为2L的密闭容器中加入一定量的A,发生如下反应并建立平衡:A(g)?2B(g) 2B(g)?2D(g)+C(g)测得平衡时各物质的浓度是:c(A)=0.3mol?L-1,c(B)=0.2mol?L-1,c(C)=0.05mol?L-1,则最初加入的A物质的量是查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示查看答案和解析>>
科目:高中化学 来源:2011年江西师大附中高考化学三模试卷(解析版) 题型:解答题
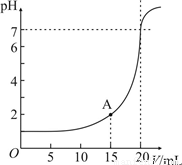
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com