
| A、室温下,将pH=2 H2SO4与pH=12 NH3?H2O溶液等体积混合后,混合液pH<7 |
| B、室温下,将pH=12 Ba(OH)2与pH=14 NaOH溶液等体积混合后,混合液13<pH<14 |
| C、室温下,将pH=13 Ba(OH)2与pH=1 HCl溶液等体积混合后,混合液的pH>7 |
| D、某温度下水的离子积为1×10-12,若使pH=1 H2SO4与pH=12 NaOH溶液混合后溶液呈中性,则两者的体积比 为1:10 |
| 0.01+1 |
| 2 |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
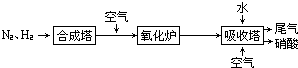
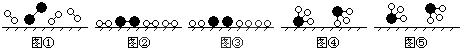
 、
、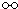 、
、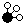 分别表示N2、H2、NH3,图⑤表示生成的NH3离开催化剂表面,则图③的含义是
分别表示N2、H2、NH3,图⑤表示生成的NH3离开催化剂表面,则图③的含义是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al和Mg |
| B、Al和Zn |
| C、Zn和Fe |
| D、Fe和Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属性 Rb>K>Mg>Al |
| B、非金属性 As>S>Cl>F |
| C、稳定性 AsH3>PH3>H2S>HF |
| D、半径 Na>P>O>F |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所含的分子数相等 |
| B、在同温同压下,V(N2)═V(NO) |
| C、所含的原子数不相等 |
| D、在同温同体积下,p(N2)<p(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油裂化可获得乙烯、丙烯和丁二烯 |
| B、石油裂解的目的主要是为了得到更多的汽油 |
| C、盐析可用于提纯蛋白质并保持其生理活性 |
| D、木糖醇(C5H12O5)是一种甜味剂,它属于多羟基化合物,与葡萄糖互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(H2O)n是一种新的水分子 |
| B、(H2O)n仍保留着水的化学性质 |
| C、1 mol(H2O)n中有2个氢键 |
| D、1 mol(H2O)n中有4 mol氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl通入Fe(NO3)2溶液中 |
| B、CO2通入Ca(NO3)2溶液中 |
| C、Cl2通入Na2SiO3溶液中 |
| D、NH3通入Ca(HCO3)2溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com