A、B、C、D、E为5种短周期元素,且原子序数依次增大。A的原子半径最小;B的电子总数与其最外层电子数之比为3:2;C的最高价氧化物对应水化物与其简单氢化物反应生成一种盐类物质甲。A、E同主族,A、B、C、E都能分别与D形成原子个数比不同的常见化合物。请回答下列问题:
(1)B在周期表中位于第______族,甲的名称是___________。
(2)A、C两元素按原子数目比3:1和2:1构成分子M和N,N的电子式为___________。在微电子工业中,M的水溶液可作刻蚀剂H
2O
2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________。
(3)由C、E组成的化合物乙是汽车安全气囊中的一种成分。现取13.0 g乙,加热使其完全分解,生成一种气体单质(标准状况下的体积为6. 72L)和一种同体单质,则乙的化学式是___________。
(4)近年来太原市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。汽车内燃机工作时引起反应:C
2(g)+D
2(g)
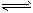
2CD(g),是导致 汽车尾气中含有CD的原因之一。T℃时,向容积为2L的密闭容器中充入10 mol C
2与5 mol D
2,达到平衡后CD的物质的量为2 mol,则T℃时该反应的平衡常数K=
____________(计算结果保留两位有效数字)。在其他条件不变的情况下,再通入10mol C
2与5 mol D
2,达到新平衡时C
2的转化率将____(填“增大”“减小”或“不变”,下同),CD的平衡浓度将____。
(5)当发动机采用稀薄燃烧时,尾气中的主要污染物为NO
x,可用C
xH
y(烃)催化还原NO
x消除氮氧化物的污染。已知:
CH
4(g)+4NO
2(g)=4NO(g)+CO
2(g)+2H
2O(g) △H1=-574 kJ/mol
CH
4(g)+4NO(g)=CO
2(g)+2H
2O(g)+2N
2O(g) △H2
CH
4(g)+2NO
2(g)=N
2(g)+CO
2(g)+2H
2O(g) △H3=-867 kJ/mol
△H2=___________。

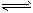 2CD(g),是导致 汽车尾气中含有CD的原因之一。T℃时,向容积为2L的密闭容器中充入10 mol C2与5 mol D2,达到平衡后CD的物质的量为2 mol,则T℃时该反应的平衡常数K=
2CD(g),是导致 汽车尾气中含有CD的原因之一。T℃时,向容积为2L的密闭容器中充入10 mol C2与5 mol D2,达到平衡后CD的物质的量为2 mol,则T℃时该反应的平衡常数K=