

 N2O4(g)可知,NO2的浓度变化是N2O4浓度变化量的2倍,据此判断;
N2O4(g)可知,NO2的浓度变化是N2O4浓度变化量的2倍,据此判断; 计算v(NO2);
计算v(NO2);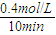 =0.04mol?L-1?min-1,故B错误;
=0.04mol?L-1?min-1,故B错误;

科目:高中化学 来源: 题型:
 2NH3,在一定条件下已达到平衡状态.
2NH3,在一定条件下已达到平衡状态. 2NH3(g)△H=-92.4KJ/mol
2NH3(g)△H=-92.4KJ/mol 2NH3(g)△H=-92.4KJ/mol
2NH3(g)△H=-92.4KJ/mol| 2-a |
| 2 |
| 2-a |
| 2 |
| 6-3a |
| 2 |
| 6-3a |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| △ |
| ||
| △ |
| ||
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式 。当温度升高时,化学平衡常数K值 (填“增大”、“减小”、“无影响”)。
(2)硝酸厂尾气常用的处理方法是:催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol
H2O(1)=H2O(g) △H=+44.0 kJ/mol
则8g H2恰好将NO2转化成N2和H2O(1)时△H= 。
(3)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2![]() 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是 (填字母)。
A.容器内N2、H2、NH3的浓度之比为l:3:2
B.![]()
C.容器内压强保持不变
D.混合气体的密度保持不变
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2 L固定容积的密闭容器中,5 min后反应达平衡时,n(N2)=1.2 mol,n(H2)=1.2 mol, n(NH3)=0.8mol,则反应速率v(N2)= ,平衡常数= (保留两位小数)。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡 (填向左、向右或不移动)移动。
查看答案和解析>>
科目:高中化学 来源:2011届宁夏银川一中高三第一次模拟考试(理综)化学部分 题型:填空题
(14分)
工业合成氨反应:N2+3H2 2NH3,在一定条件下已达到平衡状态。
2NH3,在一定条件下已达到平衡状态。
(1)若降低温度,会使上述平衡向生成氨的方向移动,生成每摩尔氨的反应热数值是46.2KJ/mol,则该反应的热化学方程式为 。
(2)若在恒温条件下,将N2与H2按一定比例混合的气体通入一个容积为2升固定容积的密闭容器中,5分钟后反应达平衡时,n(N2)="1.2mol," n(H2)="1.2mol," n (NH3)=0.8mol,则反应速率V(N2)= mol·L-1·min-1,H2的转化率= ,平衡常数= 。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡 (填向左﹑向右或不移动)移动。
(3)若在恒温恒压条件下,将1 molN2与3 molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a molNH3,这时N2的物质的量为 mol,(用含a的代数式表示);若开始时只通入N2与H2,达平衡时生成3amolNH3,则开始时应通入N2 3mol,H2 = mol(平衡时NH3的质量分数与前者相同);若开始时通入x molN2﹑6molH2和2mol NH3,达平衡后,N2和NH3的物质的量分别为y mol和3a mol,则x= mol,y= mol(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年宁夏高三第一次模拟考试(理综)化学部分 题型:填空题
(14分)
工业合成氨反应:N2+3H2 2NH3 ,在一定条件下已达到平衡状态。
2NH3 ,在一定条件下已达到平衡状态。
(1)若降低温度,会使上述平衡向生成氨的方向移动,生成每摩尔氨的反应热数值是46.2KJ/mol,则该反应的热化学方程式为 。
(2)若在恒温条件下,将N2与H2按一定比例混合的气体通入一个容积为2升固定容积的密闭容器中,5分钟后反应达平衡时,n(N2)=1.2mol, n(H2)=1.2mol, n (NH3)=0.8mol,则反应速率V(N2)= mol·L-1·min-1,H2的转化率= ,平衡常数= 。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡 (填向左﹑向右或不移动)移动。
(3)若在恒温恒压条件下,将1 molN2与3 molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a molNH3,这时N2的物质的量为 mol,(用含a的代数式表示);若开始时只通入N2与H2 ,达平衡时生成3amolNH3,则开始时应通入N2 3mol,H2 = mol(平衡时NH3 的质量分数与前者相同);若开始时通入x molN2﹑6molH2 和2mol NH3,达平衡后,N2和NH3的物质的量分别为y mol和3a mol,则x= mol,y= mol(用含a的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com