
| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 化合物中各元 素原子个数比 | A:C=1:1 | A:B=1:1 | D:C=1:1 | E:F=1:3 | B:F=1:4 |
分析 原子序数依次增大的A、B、C、D、E、F六种短周期元素,B原子最外层电子数比其次外层电子数多2个,原子只能有2个电子层,最外层电子数为4,则B为碳元素;A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和,二者不可能同周期,A的原子序数小于碳,只能处于第一周期,可推知A为H元素;C是地壳中含量最高的元素,则C为氧元素;F和E的原子序数之和为30,二者只能处于第三周期,且F和氧是周期不同、族相邻的关系,故F处于第三周期,可推知E为Al、F为Cl;丙中D、C形成原子数目1:1的化合物,而D的原子序数大于氧、小于Al,故D为Na.可推知甲为H2O2,有机物乙的分子为直线结构,则乙为C2H2,丙为Na2O2,丁为AlCl3,戊为CCl4.
解答 解:原子序数依次增大的A、B、C、D、E、F六种短周期元素,B原子最外层电子数比其次外层电子数多2个,原子只能有2个电子层,最外层电子数为4,则B为碳元素;A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和,二者不可能同周期,A的原子序数小于碳,只能处于第一周期,可推知A为H元素;C是地壳中含量最高的元素,则C为氧元素;F和E的原子序数之和为30,二者只能处于第三周期,且F和氧是周期不同、族相邻的关系,故F处于第三周期,可推知E为Al、F为Cl;丙中D、C形成原子数目1:1的化合物,而D的原子序数大于氧、小于Al,故D为Na.可推知甲为H2O2,有机物乙的分子为直线结构,则乙为C2H2,丙为Na2O2,丁为AlCl3,戊为CCl4.
(1)F为Cl元素,在周期表中的位置:第三周期VIIA族,故答案为:第三周期VIIA族;
(2)甲为H2O2,双氧水在二氧化锰作催化剂条件下分解生成氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,氧化产物为O2,有机物乙的分子为直线结构,则乙为C2H2,
故答案为:O2 ;C2H2;
(3)E单质为Al,D的最高价氧化物的水化物为NaOH,二者反应化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)以Al单质为阳极,在H2SO4溶液中电解,可以在Al表面形成致密氧化膜保护,阳极电极反应式为:2Al+3H2O-6e-=Al2O3+6H+,
故答案为:2Al+3H2O-6e-=Al2O3+6H+.
点评 本题考查元素化合物推断,充分利用短周期元素、核外电子排布特点、化合物中原子数目之比进行推断,难度中等.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=-867 kJ•mol-1 | |
| B. | CH4催化还原NOx为N2的过程中,若x=1.6,则转移电子3.2 mol | |
| C. | 若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子3.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和N2O摩尔质量相等 | |
| B. | 18g水中含有1molH2O | |
| C. | O2的摩尔质量(单位是g•mol-1)在数值上等于其相对分子质量 | |
| D. | 1mol•L-1NaCl溶液中含1molNa+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O和N2O | B. | CS2和SiO2 | C. | CH4和NH3 | D. | CO2和N2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
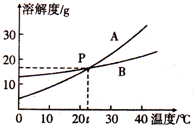 根据图中A、B两种固体物质的溶解度曲线,回答下列问题:
根据图中A、B两种固体物质的溶解度曲线,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com