
| A. | 淀粉、纤维素水解的最终产物都是葡萄糖 | |
| B. | 误服可溶性重金属盐,立即服用大量牛奶可以解毒 | |
| C. | 用灼烧的方法可鉴别毛织物和棉织物 | |
| D. | 温度越高,酶对某些化学反应的催化效率越高 |
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 自来水厂可用明矾作净水剂 | |
| B. | 二氧化硅既能与氢氟酸反应又能与氢氧化钠溶液反应,所以二氧化硅是两性氧化物 | |
| C. | 丁达尔效应是区分胶体与溶液的一种常用方法 | |
| D. | MgO、Al2O3熔点高,可用于制作耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加金属钠看是否有氢气放出 | |
| B. | 与新制的氢氧化铜悬浊液混合后共热,观察是否有红色沉淀 | |
| C. | 与醋酸和浓H2SO4共热,观察是否有果香味物质生成 | |
| D. | 加入酸性KMnO4溶液,看溶液是否褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
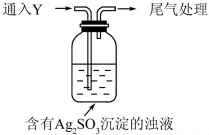 某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取碳酸钠晶体53.0g | |
| B. | 移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗 | |
| C. | 定容时,俯视观察刻度线 | |
| D. | 定容后,将容量瓶反复倒转、摇匀、静置时发现液面低于刻度线,于是又加入少量水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
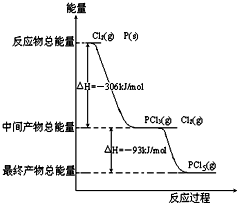 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用溴水和苯在催化剂作用下制溴苯: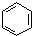 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$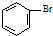 +HBr +HBr | |
| B. | 乙酸乙酯和H${\;}_{2}^{18}$O发生酸性水解反应:CH3COOC2H5+H-18OH $?_{△}^{酸}$CH3CO18OH+C2H5OH | |
| C. | 苯酚钠溶液中通入少量二氧化碳的离子方程式:2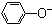 +CO2+H2O→ +CO2+H2O→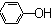 +CO${\;}_{3}^{2-}$ +CO${\;}_{3}^{2-}$ | |
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+2[Ag(NH3)2]OH$\stackrel{△}{→}$HCOONH4+2Ag↓+3NH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe和Mg与0.1 mol•L-1的盐酸反应,反应速率相同 | |
| B. | 0.1 mol•L-1的盐酸与H2SO4分别与大小、形状相同的大理石反应,反应速率相同 | |
| C. | 催化剂能降低分予活化时所需能量,使单位体积内活化分子百分数大大增加 | |
| D. | 100Ml 2mol•L-1的盐酸与锌片反应,加入适量的NaCl溶液,反应速率不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com