
| A. | 不慎打翻燃着的酒精灯,立即用湿抹布盖灭 | |
| B. | 实验室制取氯气如果有尾气处理装置,可不用在通风橱中进行 | |
| C. | 给盛有液体的试管加热时,要不断移动试管或加入碎瓷片 | |
| D. | 浓碱液滴在皮肤上,立即用大量水冲洗,然后涂上硼酸溶液 |
分析 A.隔绝空气能够灭火;
B.依据氯气有毒的性质解答;
C.通过不断移动试管可以使试管受热均匀,防止暴沸;
D.浓碱具有强烈的腐蚀性.
解答 解:A.用湿抹布盖在燃烧的酒精上,可以使酒精与氧气隔绝.故A正确;
B.氯气有毒,实验室制备氯气应在通风厨中进行,故B错误;
C.给盛有液体的试管加热时,为了防止暴沸,应该要不断移动试管或加人碎瓷片,故C正确;
D.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,降低碱溶液的浓度,然后涂上硼酸溶液来中和碱溶液,故D正确;
故选:B.
点评 本题考查化学实验中的安全及事故处理方法,熟悉药品的性质及实验操作是解题关键,旨在考查学生的基础知识的掌握,化学实验是化学的基础,要了解常见的实验事故处理方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.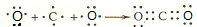
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
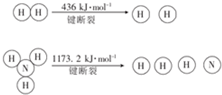
 .
.
| n(N2)/mol | N(H2)/mol | N(NH3)/mol | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
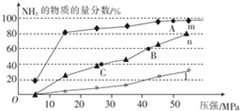
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.E是具有果香味的酯,F是一种高聚物,可制成多种包装材料.
已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.E是具有果香味的酯,F是一种高聚物,可制成多种包装材料.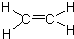 ,C的名称为乙醛.
,C的名称为乙醛.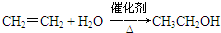 ④
④ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若所得混合溶液为中性,则a:b=1:1 | |
| B. | 若所得混合溶液为中性,则生成沉淀的物质的量为0.05b mol | |
| C. | 若a:b=9:2,则所得溶液pH等于2 | |
| D. | 若a:b=9:2,则该混合溶液最多能溶解铁粉0.28(a+b)g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com