
【题目】自然界存在反应:14CuSO4+5FeS2+12H2O→7Cu2S+5FeSO4+12H2SO4 . 在该反应中( )
A.产物中的SO ![]() 有一部分是氧化产物
有一部分是氧化产物
B.5molFeS2发生反应,有10mol电子转移
C.发生氧化反应和发生还原反应的FeS2之比为7:3
D.14mol CuSO4能氧化5molFeS2
【答案】A
【解析】解:A、由化学方程式可知,反应物中含有14molSO42﹣离子,生成物中有17molSO42﹣离子,则有3molS被氧化,产物中的SO42﹣有一部分是氧化产物,故A正确;B、5molFeS2发生反应,Cu元素化合价由+2价→+1价,14molCuSO4得到14mol电子,FeS2→Cu2S,S元素的化合价由﹣1价→﹣2价,生成7molCu2S,得到7mol电子,有21mol电子转移,故B错误;
C、由方程式可知,5molFeS2参加反应,生成7molCu2S,被还原,所以发生还原反应的FeS2为3.5mol,但是发生氧化反应的FeS2还有1.5mol,发生氧化反应和发生还原反应的FeS2之比为3:7,故C错误;
D、Cu元素化合价降低,被还原,CuSO4为氧化剂,FeS2既是氧化剂又是还原剂,是14molCuSO4还有一部分FeS2做氧化剂,所以14mol硫酸铜氧化FeS2小于5mol,故D错误.
故选A.


科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f为六种原子序数依次增大前20号主族元素,a、b、c、d位于同周期,b、f位于同主族,其中a、b、f 为金属元素,c的最外层电子数是其次外层电子数的3倍,c与f 的原子序数和是e的2倍。下列说法错误的是
A. 原子半径a>b>c>d
B. 最简单气态氢化物的稳定性e<c<d
C. 最高价氧化物对应的水化物的碱性f>b
D. fc2、ec2两种化合物中c的化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程从海带中提取碘单质。
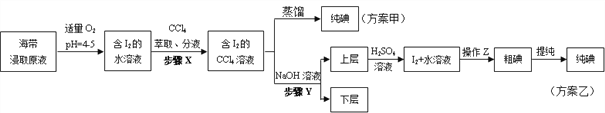
已知:3I2+6NaOH=5NaI+NaIO3+3H2O,根据以上流程,判断下列说法不正确的是( )
A. 方案甲采用蒸馏法不合理主要由于碘易升华,会导致碘的损失
B. 步骤X中,萃取后分液漏斗内观察到的现象为液体分上下两层,上层呈紫红色
C. 步骤Y中,应控制NaOH溶液的浓度和体积
D. 步骤Y的目的将碘转化成离子进入水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓硫酸 | Cu | KMnO4溶液褪色 | SO2有漂白性 | |
B | 浓盐酸 | MnO2 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
C | 稀硫酸 | 碳酸钠 | CaCl2溶液无明显变化 | CO2不与CaCl2溶液反应 | |
D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、吸水性 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,关于溶液的稀释下列说法正确的是( )
A.pH=3的醋酸溶液稀释100倍,pH=5
B.pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10﹣6 molL﹣1
C.将1L 0.1molL﹣1的Ba(OH)2溶液稀释为2L,pH=13
D.pH=8的NaOH溶液稀释100倍,其pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有pH=2的盐酸溶液100mL,要使它的pH升为3.
(1)若加入蒸馏水,应加mL(不考虑溶液体积变化,下同).
(2)若加入pH为4的盐酸溶液,应加mL.
(3)若加入0.001molL﹣1的氢氧化钠,应加mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分类或归类正确的是
①液氯、氨水、干冰、碘化银均为纯净物
②CH3COOH、HCl、H2CO3分别为一元酸、一元酸、二元酸
③CuSO4·5H2O、水银、烧碱、H2SO4均为化合物
④C60、C70、金刚石、石墨为四种单质
A.①③④ B.②③ C.②④ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组为探究SO2的漂白性和还原性,设计了以下实验.完成下列填空:
(1)实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,有下列三种硫酸溶液,应选用(选填编号),其理由是 . a.98%浓硫酸 b.70%硫酸 c.10%稀硫酸
(2).漂白性用如图所示装置(气密性良好)进行实验,观察到如下现象: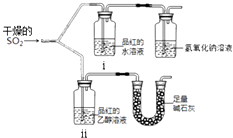
ⅰ中红色褪去、
ⅱ中无变化.
①足量碱石灰的作用是 .
②从实验中可知使品红的水溶液褪色的微粒可能是 .
(3)实验小组进一步实验如下:取等量相同浓度的品红水溶液于两支试管中,再分别加入少量Na2SO3固体和NaHSO3固体,两支试管中的品红都褪色,于是得出结论:使品红褪色的微粒肯定是HSO3﹣或SO32﹣ . 你认为这一结论是否正确 , 理由是 .
(4).还原性将SO2通入FeCl3溶液中,使其充分反应.
①SO2与FeCl3反应的离子方程式是 , 如何检验该反应所得含氧酸根离子 .
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色.
已知:红棕色为FeSO3(墨绿色难溶物)与FeCl3溶液形成的混合色;Fe3+可氧化SO32﹣ . 则②中红棕色变为浅绿色的原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ||||||||
2 | B | C | D | E | ||||
3 | A | F | J | G | I |
(1)表中元素,化学性质最不活泼的是_______,最高价氧化物的水化物酸性最强的是__________
(2)B、C、D、E、G形成的气态氢化物中,最稳定的是________________
(3)A元素的最高价氧化物的水化物中所含化学键类型_________________,D元素的简单气态氢化物的电子式为_________,J的某原子中含有15个中子,试用恰当符号表示出该原子________
(4)E、F、G形成的简单离子半径由大到小的顺序________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com