
 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:分析 (1)分析图象计算Z的消耗物质的量为0.2mol,结合反应速率概念计算,V=$\frac{△c}{△t}$;
(2)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(3)a.及时分离出Z气体,生成物的浓度减小,反应速率减慢;
b.适当升高温度,反应速率加快;
c.增大X的浓度,正逆反应速率都加快;
d.选择高效催化剂,加快化学反应速率;
(4)压强之比等于物质的量之比,由方程式可知:3X+Y?3Z,反应前总物质的量为2mol,所以X的分压为$\frac{{P}_{0}}{2}$,反应后总物质的量1.9mol,所以总物质的量减少0.1mol,而压强变化量为:P0-P,所以X的压强变化量为:3(P0-P),由此分析解答.
解答 解:(1)图象计算Z的消耗物质的量为0.3mol,从开始至2min,Z的平均反应速率=$\frac{\frac{0.3mol}{2L}}{2min}$=0.075mol/(L•min),故答案为:0.075mol/(L•min);
(2)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.3mol=3:1:3,则反应的化学方程式为:3X+Y?3Z,
故答案为:3X+Y?3Z;
(3)a.及时分离出Z气体,生成物的浓度减小,反应速率减慢,故错误; b.适当升高温度,反应速率加快,故正确;
c.增大X的浓度,正逆反应速率都加快,故正确; d.选择高效催化剂,加快化学反应速率,故正确;故选bcd;
(4)反应前总物质的量为2mol,所以X的分压为$\frac{{P}_{0}}{2}$,反应后总物质的量1.9mol,所以总物质的量减少0.1mol,而压强变化量为:P0-P,所以X的压强变化量为:3(P0-P),X的转化率为$\frac{3({P}_{0}-P)}{\frac{{P}_{0}}{2}}$×100%=$\frac{6({P}_{0}-P)}{{P}_{0}}×100%$,故答案为:$\frac{6({P}_{0}-P)}{{P}_{0}}×100%$.
点评 本题考查了化学反应速率,影响化学反应速率的因素,图象分析和反应进行方向的判断方法是解题关键,题目较简单.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.| 操作 | 现象 | 结论或目的 |
| (1)取少量溶液于试管中,向溶液中加入足量NaCl溶液 | 白色沉淀 | 除尽Ag+ |
| (2)取少量上层清液于试管中,加入取少量上述溶液于试管中加入 KSCN溶液,振荡 | 溶液变血红色 | 存在Fe3+ |
| (3)取(1)中少量上层清液于试管中,加入加入 酸性KMnO4溶液,振荡 | 紫红色消失 | 存在Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
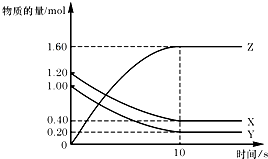 T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 平衡时X、Y的转化率相同 | |
| B. | 达到平衡后,将容器体积压缩为1L,平衡向正反应方向移动 | |
| C. | T℃时,该反应的化学方程式为:X(g)+Y(g)?2Z(g),平衡常数K=40 | |
| D. | T℃时,若起始时X为0.71mol,Y为1.00mol,则平衡时Y的转化率为60% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、H+、Al3+、CH3COO- | B. | Mg2+、HCO3-、Ca2+、NO3- | ||
| C. | K+、MnO4-、Cl-、Cu2+ | D. | NH4+、Cl-、K+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40gNaOH溶于1L水中所得的溶液 | |
| B. | 将58.5gNaCl溶于水配成1L溶液 | |
| C. | 将0.5mol•L-1氯化钠溶液100mL加热蒸发掉50g水的溶液 | |
| D. | 含K+为2mol的K2SO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com