
【题目】如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述中不正确的是( )

A. 若A为醋酸,B为贝壳(粉状),C为澄清石灰水溶液,则C中溶液变浑浊
B. 若A为浓盐酸,B为锌粒,C中盛滴有酚酞的NaOH溶液,则C中溶液褪色
C. 若A为双氧水,B为MnO2,C中为NaOH溶液,D为防倒吸装置
D. 实验中仪器D可起到防倒吸的作用
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 甲烷有两种二氯代物
B. 甲苯能使酸性高锰酸钾溶液褪色,体现了甲基对苯环的影响
C. 甲烷与乙烯可以通过燃烧的方法加以区分
D. 煤中含有苯和甲苯,通过干馏、分馏可以分离得到苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. s能级的能量一定比p能级低 B. 电子云图中小黑点多的区域表示电子多
C. 3p2表示第三能层上有两个电子 D. 同一原子中,2p、3p、4p能级的轨道数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.葡萄糖、果糖和蔗糖都能发生水解反应
B.糖类、油脂、蛋白质都是由C、H、O三种元素组成的
C.糖类、油脂、蛋白质都是高分子化合物
D.油脂有油和脂肪之分,但都属于酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究物质制备是化学学科的任务之一。
(1)请从Cl2、H2、CO2、NO、NH3五种气体中选择一种气体,该气体在实验室可用如图装置制取、净化、收集(可以含水蒸气),制取该气体的化学方程式为____________。

(2)已知: +4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O,可用下述装置制取1,2-二溴乙烷(无色液体,密度2.18g·cm-3,熔、沸点分别为9.79℃、131.4 ℃,不溶于水);试管d中装有液溴(表面覆盖少量水)。
+4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O,可用下述装置制取1,2-二溴乙烷(无色液体,密度2.18g·cm-3,熔、沸点分别为9.79℃、131.4 ℃,不溶于水);试管d中装有液溴(表面覆盖少量水)。

①e装置的作用是_________;当观察到_________现象时,试管d中反应基本结束;
②若用冰水代替烧杯中的冷水,可能引起的不安全后果是_________;
③实验后,需通过水洗、________、水洗、用干燥剂干燥、蒸馏等操作对试管d中的粗产品进行精制:
④实验消耗40%乙烯利(摩尔质量为M)溶液50g,制得产品m g,则乙烯利合成1,2-二溴乙烷的产率为____________(用含M、m的代数式表示);
⑤设计实验证明,反应后烧瓶中的混合溶液含有C1-、PO43-。简述实验方案:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照①~⑩在表中的位置,用化学用语回答下列问题:

(1)元素③形成的单质的电子式为_________;元素②形成的最高价氧化物的结构式为________。
(2)②、③、④、⑤元素形成的氢化物中,热稳定性最强的是_________(填化学式),沸点最高的是__________(填化学式)。
(3)元素⑩在周期表中的位置_________;该元素的单质主要用途________(填一种)。
(4)⑧、⑨元素的最高价氧化物的水化物酸性强弱比较__________(填化学式)。
(5)⑥、⑦两元素的最高价氧化物的水化物之间反应的离子方程式为___________。
(6)用电子式表示⑥、⑧两元素结合成化合物的形成过程__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组物质中含有的化学键类型完全相同的是
A.NaCl、HCl、NaOHB.Na2S、H2O2、H2O
C.Ar、H2SO4、SO2D.HBr、CO2、SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程如下:
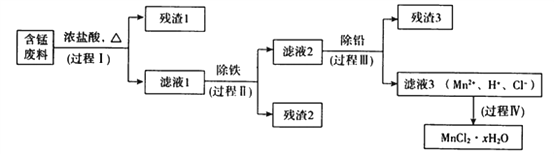
资料a.Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b.生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
注:金属离子的起始浓度为0.1 mol·L-1
(1)过程Ⅰ的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnOOH与浓盐酸反应的离子方程式是_______________________________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:_________________________________________。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3+2Cl-
b.4Fe2++O2+4H+=2Fe3++2H2O
c.……
写出c的离子方程式:____________________。
(2)过程Ⅱ的目的是除铁。有如下两种方法,
ⅰ.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ⅱ.焙烧法:将滤液1浓缩得到的固体于290℃焙烧,冷却,取焙烧物,加水溶解,过滤,再加盐酸酸化至pH小于5.5。
已知:焙烧中发生的主要反应为2FeCl3+3O2=2Fe2O3+3Cl2,MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在_____________之间。
②两种方法比较,氨水法除铁的缺点是____________。
(3)过程Ⅲ的目的是除铅。加入的试剂是____________。
(4)过程Ⅳ所得固体中的x的测定如下,取m1g样品,置于氯化氢氛围中加热至失去全部结晶水时,质量变为m2g。则x=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com