
| A. | 氧化铁 | B. | 铝热剂 | C. | 玻璃 | D. | 钢 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
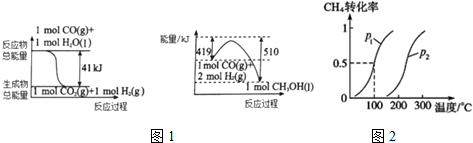
| 2min | 5min | 10min | |
| CO | 0.07 | 0.06 | 0.05 |
| H2 | 0.14 | 0.12 | 0.20 |
| CH3OH | 0.03 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
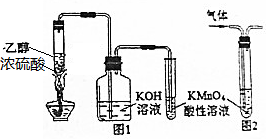
| A. | 用图1所示装置制取乙烯并验证其某些性质 | |
| B. | 用图2装置除去甲烷中的乙烯 | |
| C. | 在坩埚中灼烧CuSO4•5H2O晶体以除去结晶水 | |
| D. | 0.5g淀粉、5mL20%H2SO4和5mL蒸馏水混合,加热5min后冷却,然后向其中加入新制银氨溶液,水浴加热,无银镜反应,说明淀粉没有水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 0.70 | 23.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
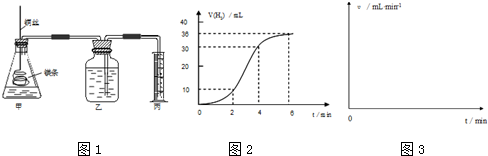
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 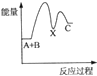 | C. | 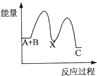 | D. | 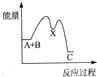 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
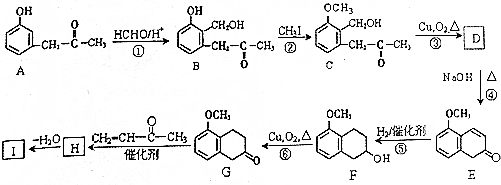
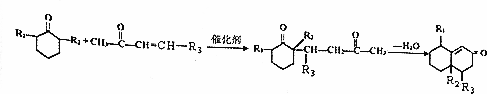
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2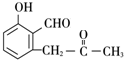 +2H2O.
+2H2O.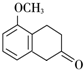 +
+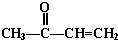 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$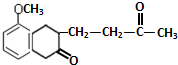 .
.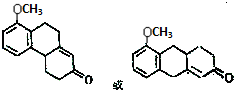 .
.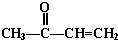 的流程图
的流程图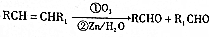 )
)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com