
【题目】Ⅰ.乙烯的产量通常用来衡量一个国家的石油化工水平。以乙烯为主要原料合重要的有机化合物路线如下图所示。请回答下列问题。
![]()
(1)A物质所含官能团的名称是____。
(2)反应③的化学方程式是____。
(3)下列物质中,不能通过乙烯加成反应得到的是____(填序号)。
a. CH3CH3 b. CH3CHCl2 c. CH3CH2Br
Ⅱ.葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是____。
(2)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是____。
②实验开始时,试管b中的导管不伸入液面下的原因是____。
(3)有机物E由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的E为无色粘稠液体,易溶于水.为研究E的组成与结构,进行了如下实验:
①称取E4.5g,升温使其汽化,测其密度是相同条件下H2的45倍. | ①有机物E的相对分子量为:__. |
②将此9.0gE在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况). | ②9.0g有机物E完全燃烧时,经计算:生成CO2共为____ mol. |
③经红外光谱测定,证实其中含有羟基,羧基,甲基 |
④写出E与NaHCO3溶液反应的化学方程式__________。
【答案】 羟基 2CH3CH2OH+O2![]() 2CH3CHO+ 2H2O b 产生红色沉淀 CH3COOH+C2H5OH
2CH3CHO+ 2H2O b 产生红色沉淀 CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O 防止溶液倒吸 90 0.3 HOOC-CH(OH)-CH3 +NaHCO3 = NaOOC-CH(OH)-CH3 + H2O + CO2↑
CH3COOC2H5+H2O 防止溶液倒吸 90 0.3 HOOC-CH(OH)-CH3 +NaHCO3 = NaOOC-CH(OH)-CH3 + H2O + CO2↑
【解析】Ⅰ. 乙烯和水发生加成生成A为CH3CH2OH,乙醇发生催化氧化生成B为CH3CHO,乙醛进一步被氧化生成乙酸,D是高分子化合物,乙烯发生加聚反应生成D为![]() ,
,
(1)乙烯和水发生加成反应CH2=CH2+H2O![]() CH3CH2OH生成A,则A是乙醇,含有官能团羟基;
CH3CH2OH生成A,则A是乙醇,含有官能团羟基;
(2)在铜或银作催化剂、加热条件下,乙醇被氧气氧化生成乙醛,反应方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(3)乙烯和氢气加成生成乙烷,和溴化氢发生加成生成溴乙烷,CH3CHCl2无法通过加成反应制得,故答案为b;
Ⅱ.(1)葡萄糖中含有醛基,能被新制的氢氧化铜悬浊液氧化,所以实验现象是产生砖红色沉淀氧化亚铜;
(2)①在浓硫酸的作用下,乙醇和乙酸发生酯化反应生成乙酸乙酯,反应的化学方程式是CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
②由于乙醇和乙酸都是和水互溶的,如果直接插入水中吸收,容易引起倒吸,所以试管b中的导管不伸入液面下的原因是防止溶液倒吸;
(4)①该有机物蒸汽密度是相同条件下H2的45倍,故有机物的相对分子质量为45×2=90;
②碱石灰增重14.2g为生成的水与部分二氧化碳的质量,10.0g白色沉淀为生成的碳酸钙,产生4.48L无色无味气体(标准状况)为碱石灰吸收的二氧化碳的体积,故碱石灰吸收的二氧化碳的物质的量为![]() =0.2mol,碳酸钙的物质的量为
=0.2mol,碳酸钙的物质的量为![]() =0.1mol,故生成的二氧化碳的总的物质的量为0.2mol+0.1mol=0.3mol,生成的水的质量为14.2g-0.2mol×44g/mol=5.4g,水的物质的量为
=0.1mol,故生成的二氧化碳的总的物质的量为0.2mol+0.1mol=0.3mol,生成的水的质量为14.2g-0.2mol×44g/mol=5.4g,水的物质的量为![]() =0.3mol;
=0.3mol;
③有机物E的物质的量为![]() =0.1mol,故分子中N(C)=
=0.1mol,故分子中N(C)=![]() =3、N(H)=
=3、N(H)=![]() =5,则分子中N(O)=
=5,则分子中N(O)=![]() =3,故有机物E的分子式为C3H6O3;
=3,故有机物E的分子式为C3H6O3;
经红外光谱测定,证实其中含有羟基,羧基,甲基,则E的结构简式为:CH3CH(OH)COOH;E与足量Na的化学方程式:CH3CH(OH)COOH+2Na→CH3CH(ONa)COONa+H2↑。


科目:高中化学 来源: 题型:
【题目】常温下,pH=10的X、Y两种碱溶液各1 mL,分别稀释到100 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
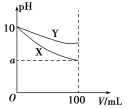
A.X、Y两种碱溶液中溶质的物质的量浓度一定相等
B.稀释后,X溶液的碱性比Y溶液的碱性强
C.分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积VX>VY
D.若8<a<10,则X、Y都是弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生下列反应,其中反应后固体质量增重的是
A. H2还原三氧化钨(WO3) B. 铝与氧化铁发生铝热反应
C. 锌粒投入硫酸铁溶液中 D. 过氧化钠吸收二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A. NA个Fe(OH)3胶体粒子的质量为107 g
B. 12g金刚石含有4NAσ键
C. 14 g分子式为CnH2n的链烃中含有的π键的数目为NA/n
D. 1 mol冰醋酸和1 mol乙醇经酯化反应可生成H2O分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将7g某铜银合金与足量的amol/L的HNO3充分反应后,放出的气体与标准状况下的氧气0.56L混合,通入水中恰好完全被吸收,此合金铜的质量是( )
A. 1.6g B. 2.4g C. 3.2g D. 4.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:硼镁矿主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:

回答下列有关问题:
(1)硼砂中B的化合价为 ,将硼砂溶于热水后,常用稀H2SO4调pH=2~3制取H3BO3,该反应的离子方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应原理为 Mg+H2O2+2H+===Mg2++2H2O, 则正极反应式为 。常温下,若起始电解质溶液pH=1,则pH=2时,溶液中Mg2+浓度为______。当溶液pH=6时, (填“有”或“没有”)Mg(OH)2沉淀析出(已知Ksp[Mg(OH)2]=5.6×10-12)。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020 g粗硼制成的BI3完全分解,生成的I2用0.30 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00 mL。该粗硼样品的纯度为____(提示:I2+2S2O===2I-+S4O)(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】顺铂[Pt(NH3)2Cl2]是1969年发现的第一种具有抗癌活性的金属配合物;碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,属于第二代铂族抗癌药物,结构简式如图所示,其毒副作用低于顺铂。下列说法正确的是( )

A. 碳铂中所有碳原子在同一个平面中
B. 顺铂分子中氮原子的杂化方式是sp2
C. 碳铂分子中sp3杂化的碳原子与sp2杂化的碳原子之比为2∶1
D. 1 mol 1,1-环丁二羧酸含有σ键的数目为12NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com