
| A. | NaX的水溶液的碱性一定强于NaY水溶液的碱性 | |
| B. | HX一定是弱酸 | |
| C. | 反应结束时两者所用时间相同 | |
| D. | 浓度:C(HX)>C(HY) |
分析 两种一元酸因为pH值相同,与过量的镁粉反应,产生气体V1>V2,说明HX溶液的浓度较大,则HX酸性较弱,反应速率与氢离子浓度成正比,以此进行分析并解答.
解答 解:A.因为酸性:HX<HY,根据越弱越水解的原理,相同浓度的NaX,NaY溶液,NaX碱性强,故A错误;
B.pH=2的两种一元酸,分别取50mL加入足量镁粉,由V(HX)>V(HY),说明HX溶液的浓度较大,则HX酸性较弱,HX一定是弱酸,故B正确;
C.开始时候PH相等,开始那一瞬间反应速率相等,但是二者生成的氢气的体积不同,所以消耗的时间不同,故C错误;
D.pH=2的两种一元酸,分别取50mL加入足量镁粉,由V(HX)>V(HY),说明HX溶液的浓度较大,所以浓度:C(HX)>C(HY),故D正确;
故选BD.
点评 本题考查弱电解质在溶液中的电离,题目难度不大,本题要注意两种酸的强弱比较的角度,不能确定是否一定是强酸.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ③ | C. | ①③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和溴水共热 | B. | 光照甲苯与氯气的混合物 | ||
| C. | 溴乙烷与NaOH溶液共热 | D. | 乙烷通入溴的四氯化碳溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨比金刚石稳定 | |
| B. | 等质量的石墨比金刚石能量高 | |
| C. | 发生了物理变化 | |
| D. | 金刚石转化为石墨没有化学键的断裂与生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
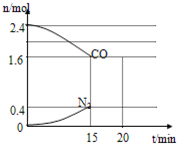 CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:
CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023个碳原子的质量为1 g | |
| B. | 钠原子的摩尔质量为23 g | |
| C. | HCl的摩尔质量等于6.02×1023个HCl分子的质量 | |
| D. | Na2O2的摩尔质量为78 g/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com