
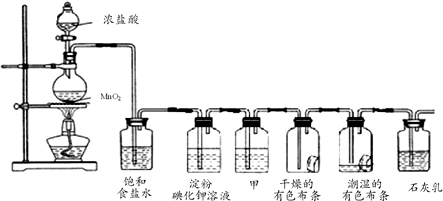
 喷泉是一种常见的自然现象,其产生的原因是存在压强差.制取氨气并完成喷泉实验(图中夹持装置均已略去).
喷泉是一种常见的自然现象,其产生的原因是存在压强差.制取氨气并完成喷泉实验(图中夹持装置均已略去).分析 (1)实验室用加热铵盐和碱的固体混合物制取氨气;
(2)根据氨气密度和溶解性分析解答;
(3)干燥气体时必须满足:气体不能与干燥剂反应;
(4)喷泉实验利用的原理是产生压强差.
解答 解:(1)实验室用加热氯化氨和消石灰的固体混合物制取氨气,方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O;
(2)氨气的密度比空气小,极易溶于水,只能用向下排气法收集,故答案为:向下排空气法;
(3)浓硫酸具有酸性,五氧化二磷为酸性氧化物,氨气是碱性气体,所以浓硫酸和五氧化二磷都不能干燥氨气,氯化钙与氨气结合生成络合物,
故答案为:B;
(4)氨气是一种极易溶于水的气体,将胶头滴管中的水挤入烧瓶中,瓶内压强减小,在外界气压的作用下,水被压到瓶内,形成喷泉现象,
故答案为:将胶头滴管中的水挤入烧瓶中,松开弹簧夹.
点评 本题考查实验装置的综合及氨气的性质,为高频考点,把握实验装置的作用、喷泉实验原理为解答的关键,侧重分析与实验能力的考查,注意压强差的产生,题目难度不大.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
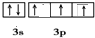 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碱式滴定管量取25.03mLH2SO4溶液 | |
| B. | 用50mL量筒量取21.48mL稀硫酸 | |
| C. | 用pH试纸测定HNO3溶液的pH=3.7 | |
| D. | 用托盘天平称取11.7gNaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:l | B. | 1:2 | C. | 3:2 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有②③ | C. | 全部 | D. | 只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
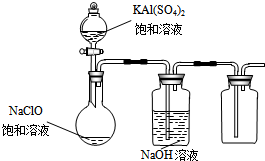 NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com