
分析 根据实验步骤可知:由含铁废铝制备硫酸铝晶体原理是用氢氧化钠溶液溶解铝,过滤除掉杂质铁,然后调节PH得到氢氧化铝沉淀,氢氧化铝和稀硫酸溶液反应生成硫酸铝,蒸发浓缩、冷却、结晶、过滤、干燥后得到硫酸铝固体.
(1)过滤操作中需要的玻璃仪器有:烧杯、漏斗、玻璃棒;
(2)Al能与氢氧化钠溶液反应,铁不能与氢氧化钠溶液反应,过滤为了固液分离;
(3)沉淀完全后上层清液里就没有AlO2-,只要检验上层清液里有无AlO2-就可以了;
(4)根据氢氧化铝不能被碳酸溶解,偏铝酸钠可以和二氧化碳之间反应生成氢氧化铝沉淀来回答.
解答 解:根据实验步骤可知:由含铁废铝制备硫酸铝晶体原理是用氢氧化钠溶液溶解铝,过滤除掉杂质铁,然后调节PH得到氢氧化铝沉淀,氢氧化铝和稀硫酸溶液反应生成硫酸铝,蒸发浓缩、冷却、结晶、过滤、干燥后得到硫酸铝固体.
(1)过滤操作中需要大小烧杯各一个、过滤器需要漏斗、玻璃棒用作引流,因此过滤操作中需要的玻璃仪器有:烧杯、漏斗、玻璃棒,
故答案为:烧杯;漏斗;
(2)Al能与氢氧化钠溶液反应,铁不能与氢氧化钠溶液反应,通过过滤将杂质铁从溶液中除掉,故答案为:除去铁等不溶于碱的杂质;
(3)检验沉淀是否完全的方法是取上层清液,逐滴加入稀硫酸,若变浑浊则说明沉淀不完全,若不变浑浊则说明沉淀完全,
故答案为:取上层清液,逐滴加入稀硫酸,若变浑浊则说明沉淀不完全,若不变浑浊则说明沉淀完全;
(4)边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,目的是生成氢氧化铝,可利用往偏铝酸钠溶液中通入足量CO2气体的方法,2H2O+AlO2-+CO2=Al(OH)3↓+HCO3-,不必控制溶液的PH就可得到最大量的沉淀,故答案为:通入足量CO2气体.
点评 本题考查金属铝的重要性质和实验操作,铝能与强碱性溶液反应是其他一般金属不具有的化学性质,掌握化学反应原理才能分析出实验步骤的目的,整合性较强,难度一般.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
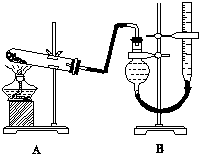 某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| ④ | 1.2g | 无其他物质 | |
| ⑤[ | 1.2g | CuO 0.5g | |
| ⑥ | 1.2g | MnO2 0.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系 能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
| A. | 容器②中达平衡时放出的热量Q=23.15 kJ | |
| B. | 平衡时,两个容器中NH3的体积分数均为$\frac{1}{7}$ | |
| C. | 容器①、②中反应的平衡常数相等 | |
| D. | 若容器①体积为0.5L,则平衡时放出的热量<23.15kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下会有气体产生,其成分中有氧气 | |
| C. | 次氯酸和过氧化钠都能使品红溶液褪色,其原理是不相同的 | |
| D. | Mg在CO2中燃烧生成MgO和C,在该反应条件下,Mg的还原性强于C的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
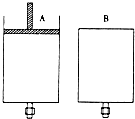 有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两只容器中分别充入等量的体积比为2:1的SO2与O2的混合气体,并使A和B容积相等(如图).在保持400℃的条件下使之发生如下反应:
有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两只容器中分别充入等量的体积比为2:1的SO2与O2的混合气体,并使A和B容积相等(如图).在保持400℃的条件下使之发生如下反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com