
| A. | 39K+和40Ca2+微粒中的电子数和中子数都相等 | |
| B. | D2和He在同温同压时,若体积相等,则质量相等 | |
| C. | 同一元素的各种同位素的物理性质、化学性质均不相同 | |
| D. | 两个质量数和电子数都相等的微粒不一定是同种元素 |
分析 A.阳离子中核外电子数=核内质子数-电荷数,中子数=质量数-质子数;
B.同温同压同体积,质量比等于摩尔质量之比,D2和He的摩尔质量相同;
C.同一元素的各种同位素的物理性质不同,化学性质基本相同;
D.两个质量数和电子数都相等的微粒不一定是同种元素.
解答 解:A.39K+中的电子数为19-1=18,中子数为39-19=20,40Ca2+中电子数=20-2=18,中子数为40-20=20,故两者的电子数和中子数都相等,故A正确;
B.同温同压同体积,质量比等于摩尔质量之比,D2和He的摩尔质量相同,故两者质量相等,故B正确;
C.同一元素的各种同位素的物理性质不同,化学性质基本相同,故C错误;
D.两个质量数和电子数都相等的微粒不一定是同种元素,如钠离子和铵根离子,故D正确;
故选C.
点评 本题考查粒子间的数量关系、阿伏伽德罗定律、同位素的性质等,知识点较多,难度中等.


科目:高中化学 来源: 题型:解答题
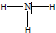 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:a>b>c>d | |
| B. | 离子半径:aAm+>bBn+>cCm->dDn- | |
| C. | 离子还原性:aA(n+1)+>bBn+,离子氧化性:cCm->dDn- | |
| D. | 单质还原性:B>A,单质氧化性:D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Penguinone分子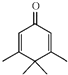 所有碳原子不可能都在同一个平面上 所有碳原子不可能都在同一个平面上 | |
| B. | 1mol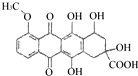 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为5 mol、3 mol、1 mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为5 mol、3 mol、1 mol | |
| C. | 醋酸和软脂酸互为同系物,C5H12和C9H20也一定互为同系物 | |
| D. | 蛋白质遇到醋酸铅生成沉淀,加入大量的水,沉淀还可溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
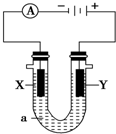 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=$\frac{1}{2}$ | |
| B. | 参加反应的氯气的物质的量等于$\frac{1}{2}$ a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$ a mol≤ne≤$\frac{5}{6}$ a mol | |
| D. | 改变温度,产物中KClO3的最大理论产量为$\frac{1}{7}$a mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com