
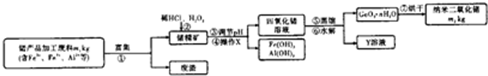
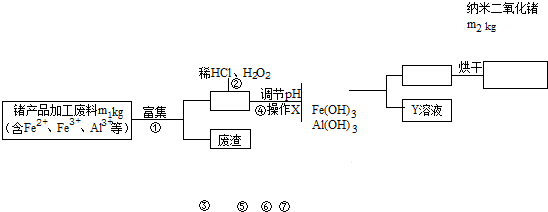
| 73 |
| 105 |
| 73m2 |
| 105m1 |
| 73 |
| 105 |
| ||
| m1 |
| 73m2 |
| 105m1 |
| 73m2 |
| 105m1 |


科目:高中化学 来源: 题型:
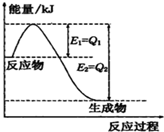 ①一定条件下,N2和H2反应生成lmolNH3过程中能量变化如图所示,则1mol N2完全反应时的焓变为:
①一定条件下,N2和H2反应生成lmolNH3过程中能量变化如图所示,则1mol N2完全反应时的焓变为:查看答案和解析>>
科目:高中化学 来源: 题型:
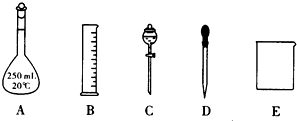
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、李比希法、钠熔法、铜丝灼烧法等都是定量研究有机物中元素组成的方法 |
| B、元素分析仪可用于分析有机物中的元素组成 |
| C、“钠熔法”的变化过程中钠必定发生还原反应 |
| D、根据1H核磁共振谱就可以确定任何有机物分子的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
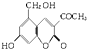 ,它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题:
,它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
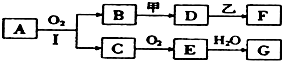
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com