高铁酸钾(K
2FeO
4)具有极高的氧化性,对环境无不良影响,被人们称为“绿色化学”试剂.某校化学兴趣小组对高铁酸钾进行了如下探究.
I、高铁酸钾制备:
①在一定温度下,将氯气通入KOH溶液中制得次氯酸钾溶液;②在剧烈搅拌条件下,将Fe(NO
3)
3 分批加入次氯酸钾溶液中,控制反应温度,以免次氯酸钾分解;③加 KOH至饱和,使K
2FeO
4 充分析出,再经纯化得产品.
(1)温度过高会导致次氯酸钾分解生成两种化合物,产物之一是氯酸钾(KClO
3),此反应化学方程式是
3KClO=KClO3+2KCl
3KClO=KClO3+2KCl
.
(2)制备过程的主反应为(a、b、c、d、e、f为化学计量系数):aFe (OH)
3+b ClO
-+cOH
-=d FeO
42-+e Cl
-+f H
2O,则a:f=
2:5
2:5
.
II、探究高铁酸钾的某种性质:
实验1:将适量K
2FeO
4分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO
42-浓度为 1.0mmol?L
-1(1mmol?L
-1=10
-3mol?L
-1)的试样,静置,考察不同初始 pH 的水溶液对K
2FeO
4某种性质的影响,结果见图1(注:800min后,三种溶液中高铁酸钾的浓度不再改变).
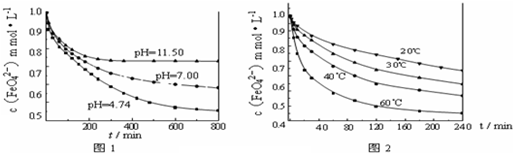
实验2:将适量 K
2FeO
4 溶解于pH=4.74 的水溶液中,配制成FeO
42-浓度为 1.0mmol?L
-1 的试样,将试样分别置于 20℃、30℃、40℃和 60℃的恒温水浴中,考察不同温度对K
2FeO
4某种性质的影响,结果见图2.
(3)实验1的目的是
探究高铁酸钾在不同pH溶液中的稳定性(或与水反应的速率)
探究高铁酸钾在不同pH溶液中的稳定性(或与水反应的速率)
;
(4)实验2可得出的结论是
温度越高,高铁酸钾越不稳定(或温度越高,高铁酸钾与水反应的速率越快)
温度越高,高铁酸钾越不稳定(或温度越高,高铁酸钾与水反应的速率越快)
;
(5)高铁酸钾在水中的反应为4FeO
42-+10H
2O?4Fe(OH)
3+8OH
-+3O
2↑.
由图1可知,800min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是
PH=11.50的溶液中OH-离子浓度大,使上述平衡向左移动
PH=11.50的溶液中OH-离子浓度大,使上述平衡向左移动
;
Ⅲ、用高铁酸钾作高能电池的电极材料:
Al-K
2FeO
4电池是一种高能电池(以氢氧化钾为电解质溶液),该电池放电时负极反应式是:
Al-3e-+4OH-=AlO2-+2H2O
Al-3e-+4OH-=AlO2-+2H2O
.

 高中必刷题系列答案
高中必刷题系列答案
