
分析 分析反应中元素化合价变化,依据氧化还原反应得失电子守恒、原子个数守恒配平,依据氧化还原反应方程式计算氧化剂的物质的量.
解答 解:该氧化还原反应中Cu元素的化合价由+2价降低到+1价,硫酸铜是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,
要使得失电子守恒H3PO4系数为24,Cu3P系数为20,依据原子个数守恒方程式为:
11P4+60CuSO4+96H2O=24H3PO4+20Cu3P+60H2SO4;
用双线桥表示为: ;
;
依据方程式可知:若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,
得到消耗氧化剂关系为:5P4+6P4+60CuSO4+96H2O=24H3PO4+20Cu3P+60H2SO4;
若有1mol H3PO4生成,则:
5P4+6P4+60CuSO4+96H2O=24H3PO4+20Cu3P+60H2SO4;
5 60 24
n n′1mol
解得n=$\frac{5}{24}$mol;n′=2.5mol;
所以若有1mol H3PO4生成,则消耗的氧化剂硫酸铜物质的量为2.5mol,消耗氧化剂P4的物质的量为$\frac{5}{24}$mol;
故答案为:11;60;96H2O;20;60;24; ;
;
消耗的氧化剂硫酸铜物质的量为2.5mol,消耗氧化剂P4的物质的量为$\frac{5}{24}$mol.
点评 本题考查了氧化还原方程式配平及氧化剂物质的量计算,明确氧化还原反应得失电子守恒、原子个数守恒是解题关键,题目难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | c(H+)+c(HB-)+2c(H2B)=c(OH-) | B. | c(Na+)+c(OH-)=c(H+)+c(HB-) | ||
| C. | c(Na+)+c(H+)=c(OH-)+c(HB-)+c(B2-) | D. | 2c(B2-)+2c(HB-)=0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
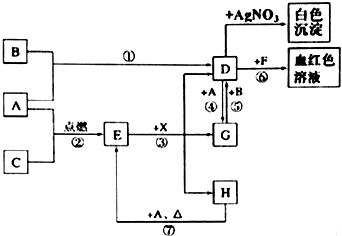
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 异常情况 | 可能原因分析 |
| A | 萃取:液体静置不分层 | 加入萃取剂的量较多 |
| B | 分液:分液漏斗中的液体难以滴下 | 没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐 |
| C | 蒸馏:温度计读数达到了馏分的沸点且历时10分钟,锥形瓶中却无液体 | 温度计位置错误,或装置漏气,或冷凝水方向反了 |
| D | 检验Fe2+:加入KSCN溶液,溶液呈红色 | Fe2+已部分被氧化成Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
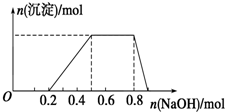 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关对该溶液的判断不正确的是( )
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关对该溶液的判断不正确的是( )| A. | 该溶液中肯定含有的离子是H+、NH4+、Al3+、SO42- | |
| B. | 肯定不含的阳离子是Mg2+、Fe3+ | |
| C. | 要确定该溶液是否含有Na+,必须做焰色反应实验,看焰色是否为黄色 | |
| D. | 该溶液中肯定含有的离子的物质的量之比为n(H+):n(NH4+):n(Al3+):n(SO42-)=2:3:1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5g甲基所含有的电子数是NA | |
| B. | 28g乙烯所含共用电子对数目为6NA | |
| C. | 17g羟基所含有的电子数是10NA | |
| D. | 标准状况下,2.24 LCCl4中含Cl原子数目等于0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
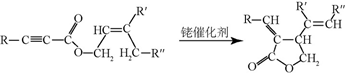
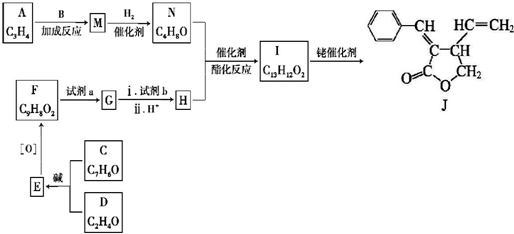
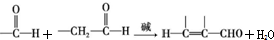
 +CH3CHO$\stackrel{碱}{→}$
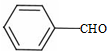
+CH3CHO$\stackrel{碱}{→}$ +H2O.
+H2O.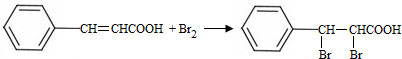 ;试剂b是NaOH、醇溶液.
;试剂b是NaOH、醇溶液.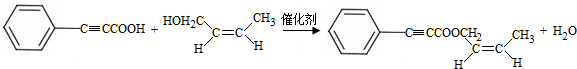 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{b-2c}{a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-2c}{a}$ | D. | $\frac{2b-4c}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
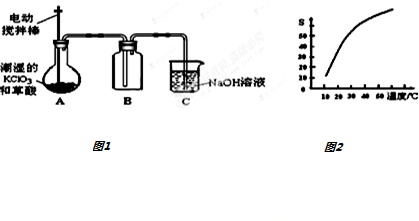
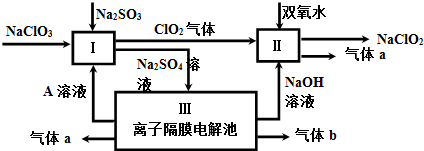
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com