
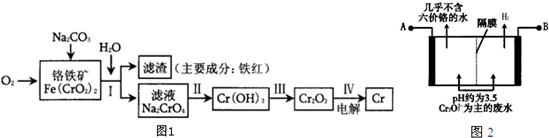
分析 (1)①8Na2CrO4+6Na2S+23H2O═8Cr(OH)3↓+3Na2S2O3+22NaOH中,Cr元素的化合价由+6价降低为+3价,生成1mol Cr(OH)3时转移电子1mol×(6-3);
②步骤IV中可用铝于Cr2O3在加热条件下制备Cr;
(2)由图可知,B端生成氢气,则B端氢离子得到电子,所以B为负极,则A为正极;阳极发生Cr2O72-、Fe2+的氧化还原反应,所以阳极几乎不含Cr2O72-;
(3)①酸性条件下,CrO42-和氢离子反应生成Cr2O72-;
②根据反应物、生成物及反应条件书写方程式,并根据得失电子相等配平方程式;
③根据Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O,I2+2S2O32-═2I-+S4O62-得关系式Cr2O72-----6S2O32-,
根据Cr2O72-和6S2O32-的关系式计算Cr2O72-的物质的量,根据原子守恒计算(NH4)2Cr2O7的质量,再根据质量分数公式计算其质量分数即可.
解答 解:(1)①8Na2CrO4+6Na2S+23H2O═8Cr(OH)3↓+3Na2S2O3+22NaOH中,Cr元素的化合价由+6价降低为+3价,则Na2CrO4为氧化剂,该反应中生成1mol Cr(OH)3时转移电子1mol×(6-3)=3mol,
故答案为:Na2CrO4;3;
②步骤IV中可用铝于Cr2O3在加热条件下制备Cr,反应的方程式为Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr,
故答案为:Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr;
(2)由图可知,B端生成氢气,则B端氢离子得到电子,所以B为负极,则A为正极;阳极发生Cr2O72-、Fe2+的氧化还原反应,所以阳极几乎不含Cr2O72-;,则阳极的氧化还原反应为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:正极;Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(3)①酸性条件下,CrO42-和氢离子反应生成Cr2O72-,离子方程式为:2CrO42-+2H+?Cr2O72-+H2O,
故答案为:2CrO42-+2H+?Cr2O72-+H2O;
②在加热条件下,(NH4)2Cr2O7分解生成N2及Cr2O3,同时还生成水,则该反应方程式为:(NH4)2Cr2O7$\frac{\underline{\;\;△\;\;}}{\;}$Cr2O3+N2↑+4H2O,
故答案为:(NH4)2Cr2O7$\frac{\underline{\;\;△\;\;}}{\;}$Cr2O3+N2↑+4H2O;
③根据Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O,I2+2S2O32-═2I-+S4O62-得关系式Cr2O72-----6S2O32-,
设Cr2O72-的物质的量为x,
Cr2O72-----6S2O32-,
1 6
x 0.1000mol/L×0.03L
1:6=x:(0.1000mol/L×0.03L)
x=0.0005mol,
根据原子守恒得n(Cr2O72-)=n((NH4)2Cr2O7),
则m((NH4)2Cr2O7)=0.0005mol×252g/mol=0.126g,
其质量分数=$\frac{0.126g}{0.140g}$×100%=90%,故答案为:90%.
点评 本题以铬为载体考查了实验制备原理,涉及质量分数的计算、氧化还原反应中离子方程式的书写、电解原理等知识点,综合性较强,注意从整体上把握制备流程,明确制备原理,再结合教材基础知识分析解答,题目中信息量较大,同时考查学生信息筛选能力及加工能力,难度较大.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将苯和溴水混合后加入Fe粉制溴苯 | |
| B. | 为检验皂化反应进行程度,取几滴反应液,滴入装有热水的试管中,振荡,若无油滴浮在液面上,说明油脂已完全反应 | |
| C. | 检验淀粉在稀硫酸催化条件下水解产物的方法是:取适量水解液于试管中,加入少量新制Cu(OH)2悬浊液,加热煮沸,观察是否出现红色沉淀 | |
| D. | 探究化学反应的限度:取5ml 0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5-6滴,充分反应,根据溶液中是否含有碘单质和碘离子判断该反应有一定限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H>0
甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H>0查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al2(S04)3溶液中加入过量氨水:Al3++4NH3.H2O=AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++N03-=3Fe3++NO↑+2H2O | |
| D. | 碱性锌锰电池正极反应:2MnO2+2H2O+2e一=2MnOOH+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA | |
| B. | 在标准状况下,2.24L乙烷中含有的化学键数为0.6NA | |
| C. | 100mL 0.1mol•L-1 Na2SO4溶液中含有的O原子数为0.04NA | |
| D. | 25℃时,1.0L pH=3的CH3COOH溶液中含有的H+数小于10-3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 用品名称 | 煤炭  | 酚醛树脂手柄 | 明矾  | 手工肥皂  |
| 主要成分 | C 碳单质 | 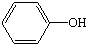 苯酚 | Al2(SO4)3•12H2O 十二水合硫酸铝 | C17H35COONa 硬脂酸钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
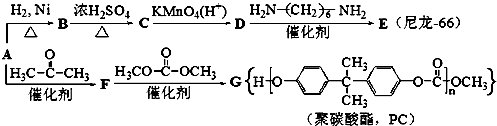
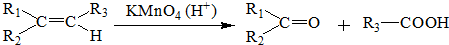
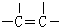 .
.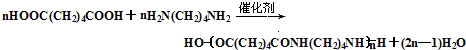 .
.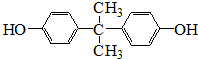 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com