
 为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;若生成4.29g Cu2(OH)3Cl,则理论上耗氧体积为0.448L(标准状况).
为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;若生成4.29g Cu2(OH)3Cl,则理论上耗氧体积为0.448L(标准状况). 分析 (1)A.催化剂降低了反应的活化能,增大活化分子百分数;
B.催化剂降低了反应的活化能,增大活化分子百分数,增大活化分子之间的碰撞机会;
C.催化剂改变反应路径,但焓变不变;
D.平衡常数只与温度有关;
(2)Ag2O与有害组分CuCl2发生复分解反应,则二者相互交换成分生成另外的两种化合物;
(3)Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀;
n[Cu2(OH)3Cl]=$\frac{4.29g}{214.5g/mol}$=0.05mol,根据转移电子计算氧气物质的量,再根据V=nVm计算体积.
解答 解:(1)A.催化剂降低了反应的活化能,增大活化分子百分数,故A正确;
B.催化剂降低了反应的活化能,增大活化分子百分数,增大活化分子之间的碰撞机会,所以反应速率增大,故B正确;
C.催化剂改变反应路径,但焓变不变,故C错误;
D.平衡常数只与温度有关,温度不变,平衡常数不变,与催化剂无关,故D错误;
故选AB;
(2)Ag2O与有害组分CuCl2发生复分解反应,则二者相互交换成分生成另外的两种化合物,
反应方程式为Ag2O+CuCl2=2AgCl+CuO,
故答案为:Ag2O+CuCl2=2AgCl+CuO;
(3)Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;n[Cu2(OH)3Cl]=$\frac{4.29g}{214.5g/mol}$=0.02mol,根据转移电子得n(O2)=$\frac{0.02mol×2×2}{4}$=0.02mol,V(O2)=0.02mol×22.4L/mol=0.448L,
故答案为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;0.448.
点评 本题考查较综合,侧重考查学生自身综合应用及计算能力,涉及氧化还原反应计算、离子方程式及复分解反应方程式的书写、原电池原理、催化剂的作用等知识点,利用原电池原理、物质性质及转移电子守恒进行解答,易错点是(3)题,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑦⑨ | B. | ①②⑤⑥⑧ | C. | ③④⑤⑦ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)、乙硫醇(C2H5SH)],可以用氢氧化钠溶液洗涤除去.
天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)、乙硫醇(C2H5SH)],可以用氢氧化钠溶液洗涤除去.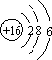 ;羰基硫分子的电子式为
;羰基硫分子的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向煮沸的1mol/L NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 | |
| B. | 用氢氧化铜粉末检验尿糖 | |
| C. | 用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 | |
| D. | 用醋和澄清石灰水验证蛋壳中含有碳酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 得到2.54 g沉淀时,加入NaOH溶液的体积是700 mL | |
| B. | 该合金中铜与镁的物质的量之比是2:1 | |
| C. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳分子的比例模型 | B. | 次氯酸的结构式为H-Cl-O | ||
| C. | CO2的电子式是: | D. | ${\;}_{8}^{18}$O2-离子结构示意图: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com