
配制0.1 mol/L的NaCl溶液,下列操作会导致所配溶液浓度偏高的是( )
A.称量时,左盘高,右盘低 B.定容时俯视读取刻度
C.容量瓶洗净后未干燥 D.定容时液面超过了刻度线
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
 (1)O3将I-氧化成I2的过程由3步反应组成:
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)==IO-(aq)+O2(g) △H1
②IO-(aq)+H+(aq) HOI(aq) △H2
HOI(aq) △H2
③HOI(aq)+ I-(aq)+ H+(aq) I2(aq)+H2O(l) △H3
I2(aq)+H2O(l) △H3
总反应的化学方程式为______,其反应△H=______。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq) I3-(aq),其平衡常数表达式为_______。
I3-(aq),其平衡常数表达式为_______。
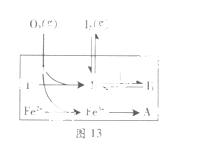
(3)为探究Fe2+对氧化I-反应的影响(反应体系如图13),某研究小组测定两组实验中I3-浓度和体系pH,结果见图14和下表。
|
| 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+ I- | 5.2 | 11.0 |
| 第2组 | O3+ I-+ Fe2+ | 5.2 | 4.1 |
①第1组实验中,导致反应后pH升高的原因是_______。
②图13中的A为 。由Fe3+生成A的过程能显著提高I-的转化率,原因是_______。
③第2组实验进行18s后,I3-下降。导致下降的直接原因有(双选)______。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图14,计算3~18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
浓度为2 mol/L的NaOH溶液的正确含义是( )
A.在2 L水中溶有80克的NaOH
B.80克NaOH溶于1 L水配成的溶液
C.在1升溶液中含有80克NaOH
D.在2 L溶液中含有80克NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
下列哪些量为已知条件时,可用于求物 质的量浓度?先找出有关组合(填代号),再写出由这些量求物质的量浓度的计算式(每种情
质的量浓度?先找出有关组合(填代号),再写出由这些量求物质的量浓度的计算式(每种情 况最多只能选择三个量)。
况最多只能选择三个量)。
①溶液体积V(L) ②溶液的密度d(g·mL-1) ③溶质的摩尔质量M(g·mol-1)
④溶质的质量分数w ⑤溶质的质量m(g) ⑥气态溶质在标准状况下的体积V′(L)
第一种情况:已知________,则c=________mol·L-1;
第二种情况:已知________,则c=________mol·L-1;
第三种情况:已知________,则c=________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下述实验不能达到预期实验目的的是
| 选项 | 实验内容 | 实验目的 |
| A | 将2.5 g CuSO4·5H2O溶解在97.5 g 水中 | 配制质量分数为1.6%的CuSO4溶液 |
| B | 向盛有1 mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C | 取少量待检固体溶于水中,滴加少量Ba(OH)2溶液,观察是否有白色沉淀生成 | 检验NaHCO3固体中是否含Na2CO3 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体从分液漏斗上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
分类是化学研究中常用的方法.下列分类方法中,不正确的是 ( )
A.依据分子组成中含有氢原子的数目,将酸分为一元酸、二元酸等
B.依据是否有电子转移,将化学反应分为氧化还原反应和非氧化还 原反应
原反应
C.依据能量的变化,将化学反应分为放热反应和吸热反应
D.依据组成元素的种类,将纯净物分为单质和化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,可逆反应X(g) + 3Y(g)  2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
 A.c1:c2 = 1:3 B.平衡时,Y和Z的生成速率之比为3:2
A.c1:c2 = 1:3 B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等 D.c1的取值范围为0 < c1 < 0.14mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)恒温,容积为1 L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1
所示(已知:2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
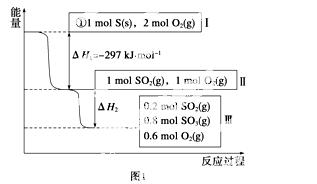
①写出能表示硫的燃烧热的热化学方程式:________________________________
______________________________________________________________________。
②ΔH2=__________kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为______________;此时该反应________(填“放出”或“吸收”)________kJ的能量。
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
①有效“减碳”的手段之一是节能,下列制氢方法最节能的是________(填序号)。
A.电解水制氢:2H2O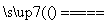 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O(g)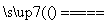 2H2+O2
2H2+O2
C.太阳光催化分解水制氢:2H2O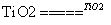 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O(g)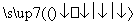 CO+3H2
CO+3H2
②CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。
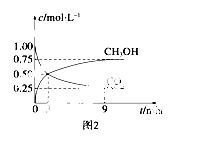 从3 min到9 min,v(H2)=________mol·L-1·min-1。
从3 min到9 min,v(H2)=________mol·L-1·min-1。
③能说明上述反应达到平衡状态的是________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即
图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g)CH3OH(g)的平衡常数。下列说法正确的是________。
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应ΔS<0
C.在T ℃时 ,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D. 工业上采用稍高的压强(5 MPa)和250 ℃,是因为此条件下,原料气转化率最高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com