
用36.5%的浓盐酸(密度1.2 g·cm-3)配1 mol·L-1的稀盐酸 100 mL,配制过程需用到的仪器组合正确的是
①100 mL量筒;②10 mL量筒;③50 mL 烧杯;④托盘天平;⑤100 mL容量瓶;⑥胶头滴管;⑦玻璃棒
A.①③⑤⑥⑦ B.②③⑦⑤⑥
C.③⑤⑦⑥① D.④③⑦⑤⑥
科目:高中化学 来源:2016届广西省高三上学期期中测试化学试卷(解析版) 题型:填空题
太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.
回答下列问題:
(1)二价铜离子的电子排布式为 .已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释
(2)(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为_________.类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N )的沸点低于异硫氰酸(H﹣N=C=S)的沸点.其原因是 .
(3)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3·NH3.在BF3·NH3中B原子的杂化方式为 ,B与N之间形成配位键,氮原子提供 .
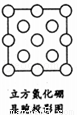
(4)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为 .六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构和硬度都与金刚石相似,晶胞边长为361.5pm,立方氮化硼的密度是 g/cm3.(只要求列算式).
(5)如图是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置。
查看答案和解析>>
科目:高中化学 来源:2016届陕西省西安市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列各组中的反应,属于同一反应类型的是
A.乙醇和乙酸制乙酸乙酯;苯的硝化反应
B.乙烷和氯气制氯乙烷;乙烯与氯化氢反应制氯乙烷
C.葡萄糖与新制氢氧化铜共热;蔗糖与稀硫酸共热
D.乙醇和氧气制乙醛;苯和氢气制环己烷
查看答案和解析>>
科目:高中化学 来源:2016届江西省高安市高三上学期第二次段考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O
B.0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:
Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3-
查看答案和解析>>
科目:高中化学 来源:2016届山东省临沂市高三上学期10月阶段性教学质检化学试卷(解析版) 题型:选择题
常温下,将Cl2缓缓通入水中至饱和,然后向所得饱和溶液中滴加0.1mol·L-1 NaOH溶液,整个过程中pH的变化如图所示。下列有关叙述正确的是

A.从反应开始至②点,发生反应的离子方程式为:Cl2 +H2O == ClO-+ 2H++ Cl-
B.③处表示氯气和NaOH溶液恰好完全反应
C.②点所表示的溶液中所存在的具有氧化性的含氯元素的微粒主要有:Cl2 、HClO、ClO-
D.从反应开始至②点可用pH试纸测定溶液的pH
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上学期10月月考化学试卷(解析版) 题型:选择题
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是

A.X为直流电源的负极,Y为直流电源的正极
B.阳极区pH增大
C.图中的b>a
D.该过程中的产品还有H2SO4
查看答案和解析>>
科目:高中化学 来源:2016届陕西省西安市高三上学期10月月考化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。下列叙述正确的是
A.原子最外层电子数由多到少的顺序:Y、X、W、Z
B.原子半径由大到小的顺序:W、Z、Y、X
C.元素非金属性由强到弱的顺序:Z、W、X
D.简单气态氢化物的稳定性由强到弱的顺序:X、Y、W
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中测试化学试卷(解析版) 题型:填空题
(11分)已知某气体反应的平衡常数可表示为K= ,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44.
,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44.
请回答下列问题:
(1)写出上述反应的化学方程式______________________________.
(2)该反应的正反应是__________反应(填“放热”或者“吸热”),
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
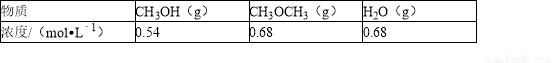
①此时系统温度400℃,比较正、逆反应速率的大小:v正__________v逆(填“>”、“<”或“=”).
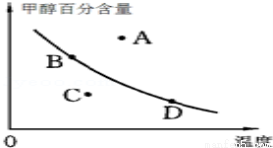
②若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中___________点.比较图中B、D两点所对应的正反应速率B__________D(填“>”、“<”或 “=”).理由是__________.
(4)一定条件下要提高反应物的转化率,可以采用的措施是__________
a.升高温度 b.加入催化剂 c.压缩容器的体积
d.增加水蒸气的浓度 e.及时分离出产物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上学期期中必修化学试卷(解析版) 题型:选择题
黑火药在适当的外界能量作用下,能进行迅速而有规律的燃烧,瞬间产生大量的热和氮气、二氧化碳等气体,由于体积急剧膨胀,压力猛烈增大,于是发生了爆炸。
反应方程式为S+2KNO3+3C===K2S+N2↑+3CO2↑,下列说法不正确的是
A.S和KNO3都是反应的氧化剂
B.C在反应中得电子
C.CO2是反应的氧化产物
D.K2S和N2都是反应的还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com