
【题目】属于电解质,且溶于水时会影响水的电离平衡的是
A. 氯气 B. 二氧化碳 C. 碘化钾 D. 醋酸钠
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
【题目】二氧化硫和氮的氧化物是大气的主要污染物,防止和治理其对环境的污染是当前环保工作的重要研究内容之一.
(1)一定条件下,发生反应2SO2(g)+O2(g)2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的物质的量为1mol,则该可逆反应的平衡常数K=;恒温下,若往容器中再加入2mol SO2(g),则重新达到平衡时SO2的总转化率 0%(填“>”、“<”或“=”).
(2)在一密闭容器中发生反应2NO22NO+O2△H>0,反应过程中NO2的浓度随时间变化的情况如图所示.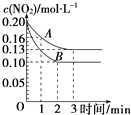
请回答:
①依曲线A,反应在前3min内氧气的平均反应速率为 .
②若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则此条件可能是(填“浓度”、“压强”、“温度”或“催化剂”).
(3)一定温度下,在密闭容器中N2O5可发生下列反应:
①2N2O5(g)4NO2(g)+O2(g)
②2NO2(g)2NO(g)+O2(g)
若达平衡时,c(NO2)=0.4molL﹣1 , c(O2)=1.3molL﹣1 , 则反应②中NO2的转化率为 , N2O5(g)的起始浓度应不低于 molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应Na2CO3+2HCl=2NaCl+H2O + CO2↑的离子方程式是
A. CO32-+2H+ = H2O+CO2↑B. CO32-+H+=H2O+CO2↑
C. CO32-+2HCl=2Cl-+H2O+CO2↑D. Na2CO3+2H+=2Na++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42﹣ ![]() 2PbSO4+2H2O则下列说法正确的是( )
2PbSO4+2H2O则下列说法正确的是( ) 
A.放电时:电子流动方向由A经导线流向B
B.放电时:正极反应是Pb﹣2e﹣+SO42﹣ ![]() PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4﹣2e﹣+2H2O=PbO2+SO42﹣+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
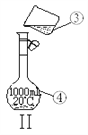
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
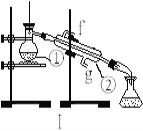
(1)写出下列仪器的名称:①__________;②_________ 。
(2)若利用装置I制取蒸馏水,将仪器补充完整后进行实验,冷却水从____________口进。(填g或f)
(3)现需配制250 mL 0.2 mol·L—1 NaCl溶液,其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误,一处是未用玻璃棒引流,另一处是_________________ 。
(4)在配制过程中,其他操作都是正确的,下列情况对所配制的NaCl溶液的浓度偏低有______。
A.没有洗涤烧杯和玻璃棒 B.容量瓶不干燥,含有少量蒸馏水 C.定容时俯视刻度线 D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有混有氯化钠杂质碳酸钠固体,为测定其中碳酸钠的质量分数,设计如下方案:
(1)称取20.0g上述固体,溶于水配成溶液,加入过量的CaCl2溶液,溶液变浑浊,过滤洗涤干燥,得到固体10g,求碳酸钠的质量分数。______________
(2)现取等质量的上述固体,加入过量的盐酸,求生成的气体在标准状况下的体积。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)下列物质中:①能导电的是________(填代号,以下同);
②属于电解质的是____________;
③属于非电解质的是____________。
A.NaOH溶液 B.Cu C.液态HCl D.蔗糖溶液
E.液氯 F.氨水 G.胆矾晶体 H.无水乙醇
(2)若将0.2mol钠、镁、铝分别投入到100mL1mol·L-1的盐酸中,在标准状况下,产生氢气体积之比是_____________。
(3)取等质量的铁硅合金样品两份,分别投入到足量的稀盐酸和足量的稀氢氧化钠溶液中,充分反应后,收集到等量的氢气,则原合金样品中铁和硅的物质的量之比为______________________。
(4)向盛有10mL1mol·L-1NH4Al(SO4)2溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
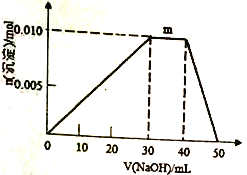
①写出m点反应的离子方程式____________________________________。
②若NH4Al(SO4)2溶液改加20mL1.2mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.
(1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣a kJmol﹣1;E(H﹣H)=b kJmol﹣1 , E(Cl﹣Cl)=c kJmol﹣1 , 则:E(H﹣Cl)=;
(2)氯原子对O3的分解有催化作用:O3(g)+Cl(g)=ClO(g)+O2(g)△H1 , ClO(g)+O(g)=Cl(g)+O2(g)△H2 , 大气臭氧层的分解反应是O3+O=2O2△H.该反应的能量变化示意图如图1所示.则反应O3(g)+O(g)=2O2(g)的正反应的活化能为kJmol﹣1 . 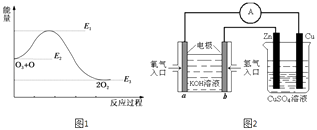
(3)实验中不能直接测出由石墨和氢气反应生成甲烷反应的反应热,但可测出CH4、石墨和H2燃烧反应的反应热,求由石墨生成甲烷的反应热.已知:
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣a kJmol﹣1
②C(石墨)+O2(g)═CO2(g)△H=﹣b kJmol﹣1
③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣c kJmol﹣1
O2(g)═H2O(l)△H=﹣c kJmol﹣1
则反应C(石墨)+2H2(g)→CH4(g)的反应热:
△H=kJmol﹣1 .
又已知:该反应为放热反应,△H﹣T△S可作为反应方向的判据,当△H﹣T△S<0时可自发进行;则该反应在什么条件下可自发进行 . (填“低温”、“高温”)
(4)有图2所示的装置,该装置中Cu极为极;当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有大量下列离子:Fe3+、SO42-、Al3+和M离子,且这四种离子Fe3+、SO42-、Al3+和M的物质的量之比为2:4:1:1,则M离子可能为下列中的( )
A.Na+B.I-C.S2-D.Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com