
【题目】研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,其放电工作原理如下图所示。下列说法正确的是
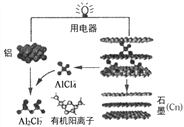
A. 放电时,电子由石墨(Cn)电极经用电器流向铝电极
B. 放电时,有机阳离子向铝电极方向移动
C. 充电时,铝电极上发生氧化反应
D. 放电时,负极的电极反应为:Al-3e-+7AlCl4-=4Al2Cl7-
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A. 质子数相同的原子,其核外电子排布也相同
B. 质量数相同的原子,其化学性质一定相同
C. 金属性越活泼,其原子在反应中越易失去电子
D. 非金属性越活泼,其阴离子越难失去电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)拆开1 mol H-H键、1 mol N-H键、1 mol N≡N键需要的能量分别是436 kJ、391 kJ、946 kJ,则1 mol N2生成NH3的反应热为__________,1 mol H2生成NH3的反应热为__________。
(2) 写出298 K 101 kPa时,用CO(g)还原1 mol Fe2O3(s),放热24.8 kJ的热化学方程式:________________________________________________________。
(3) 已知N2(g)+2O2(g)====2 NO2(g);△H=+67.7 kJ·mol-1,
N2H4(g)+O2(g)=== N2(g)+2H2O (g);△H=-534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒压下,在容积可变的密闭容器中发生如下反应:A(g)+ B(g)![]() C(g)。若开始时通入1molA和1molB,到达平衡后生成amolC,则下列说法错误的是
C(g)。若开始时通入1molA和1molB,到达平衡后生成amolC,则下列说法错误的是
A. 若开始时通入3molA和3molB,到达平衡后,生成C的物质的量为3amol
B. 若开始时通入xmolA、2molB和1molC,到达平衡后,A和C的物质的量分别为ymol和3amol,则x = 2,y = 3-3a
C. 若开始时通入2molA、2molB和1molC,到达平衡后,B的物质的量一定大于2mol
D. 若开始时通入2molA、2molB和1molC,到达平衡后,再通入3molC,则再次达平衡后,C的物质的量分数为a / (2-a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能用勒沙特列原理解释的是
A. Fe(SCN)3溶液中加入固体KSCN后颜色变深,新制的氯水在光照条件下颜色变浅
B. 2NO2![]() N2O4缩小体积增大压强,c(NO2)增大
N2O4缩小体积增大压强,c(NO2)增大
C. SO2催化氧化成SO3的反应,往往需要使用催化剂
D. H2、I2、HI平衡混和气加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是张丽同学写的四个化学反应方程式及注明的反应类型,其中对应不正确的是( )
A.C+O2![]() CO2化合反应
CO2化合反应
B.2H2O2![]() 2H2O+O2↑分解反应
2H2O+O2↑分解反应
C.KCl+AgNO3=AgCl↓+KNO3复分解反应
D.3CO+Fe2O3![]() 2Fe+3CO2置换反应
2Fe+3CO2置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化学反应方程式及反应类型均正确的是
选项 | 化学反应方程式 | 反应类型 |
A | CH3COOH+CH3CH2OH | 酯化反应 |
B | CH4+Cl2 | 置换反应 |
C | CH2=CH2+Br2 CH3CHBr2 | 加成反应 |
D |
| 取代反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2X(g) +Y(g)![]() 2Z(g),下列说法中正确的是
2Z(g),下列说法中正确的是
A. 由于K=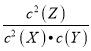 ,随着反应的进行,Z的浓度不断增大,X、Y浓度不断减小,平衡常数不断增大
,随着反应的进行,Z的浓度不断增大,X、Y浓度不断减小,平衡常数不断增大
B. 当温度不变时,增大反应物的浓度,使K变小
C. 可逆反应达到平衡时,逆反应便立即停止了
D. 温度发生变化,上述反应的K值也发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com