
| A. | 加入Al能放出H2的溶液中:NH4+,SO42-,Br-,NO3- | |
| B. | 通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ | |
| C. | 无色强酸性溶液中:Na+、Cl-、SO42-、Cu2+ | |
| D. | c(I-)=0.1 mol•L-1的溶液中:Na+、Fe2+、Cl-、SO42- |
分析 A.加入Al能放出H2的溶液中存在大量氢离子或氢氧根离子,铵根离子与氢氧根离子反应,硝酸根离子在酸性条件下与铝反应不会生成氢气;
B.铁离子能够氧化二氧化硫,硝酸根离子在酸性条件下能够氧化二氧化硫;
C.铜离子为有色离子;
D.c(I-)=0.1 mol•L-1的溶液中,四种离子之间不反应,都不与碘离子反应.
解答 解:A.加入Al能放出H2的溶液为酸性或碱性溶液,NH4+与氢氧根离子反应,NO3-在酸性溶液中具有强氧化性,与Al反应不会生成氢气,在溶液中一定不能大量共存,故A错误;
B.Fe3+和H+、NO3-都能够将SO2氧化成硫酸,Ba2+与硫酸反应生成硫酸钡沉淀,通入二氧化硫后不能大量共存,故B错误;
C.Cu2+为有色离子,在溶液中不能大量共存,故C错误;
D.Na+、Fe2+、Cl-、SO42-之间不发生反应,都不与I-反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 增加FeS2的量 | B. | 增大O2的浓度 | C. | 升高温度 | D. | 减小压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅠA元素的电负性从上到下逐渐减小,ⅦA元素的第一电离能从上到下逐渐减小 | |
| B. | 电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度 | |
| C. | NaH的存在能支持可将氢元素放在ⅦA的观点 | |
| D. | 氢原子中只有一个电子,故氢原子只有一个原子轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
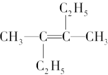 的命名正确的是( )
的命名正确的是( )| A. | 2,3-二乙基-2-丁烯 | B. | 2,3-二乙基-3-丁烯 | ||
| C. | 3-甲基-2-乙基-2-戊烯 | D. | 3,4-二甲基-3-己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +7,-1 | -2 |
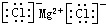 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸性高锰酸钾溶液鉴别乙烷和乙烯 | |
| B. | 用分液漏斗分离乙醛和水 | |
| C. | 用苯、溴水和铁粉混合制取溴苯 | |
| D. | 用紫色石蕊溶液检验苯酚弱酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com