
【题目】用石墨作电极电解下列溶液①稀H2SO4 ②K2SO4溶液 ③CuCl2溶液 ④CuSO4溶液 ⑤KOH溶液
(1)阴极、阳极都有气体产生,且体积比(相同条件下)为2∶1的是(填序号)__________,其阳极的电极反应式都是_________________________________________________,
阴极的电极反应式都是_________________________________________________,
总反应的化学方程式都是_________________________________________________。
(2)阴极、阳极都有气体产生,其中溶液酸性增强的是____________________。 (填序号)。
(3)一个电极析出金属,另一个电极逸出刺激性气味气体的是_______(填序号),
其阳极的电极反应式是___________________________________________。
【答案】①②⑤4OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O![]() 2H2↑ +O2↑①③2Cl--2e-=Cl2↑
2H2↑ +O2↑①③2Cl--2e-=Cl2↑
【解析】
(1)电解水时,阴极氢离子放电,生成氢气,阳极氢氧根离子放电,生成氧气,两极都有气体产生,且体积比(相同条件下)为2:1,电解①②⑤时,均相当于电解水,阴极氢离子放电,生成氢气,即2H++2e-=H2↑,阳极氢氧根离子放电,生成氧气,即4OH--4e-=2H2O+O2↑,总反应为:2H2O![]() 2H2↑ +O2↑,故答案为:①②⑤;4OH--4e-=2H2O+O2↑;2H++2e-=H2↑;2H2O
2H2↑ +O2↑,故答案为:①②⑤;4OH--4e-=2H2O+O2↑;2H++2e-=H2↑;2H2O![]() 2H2↑ +O2↑;
2H2↑ +O2↑;
(2)电解①②⑤时,两极都有气体产生,电解③④时,阴极Cu2+放电,没有气体产生,①溶液的浓度增大,pH变小;②溶液的浓度增大,pH不变;⑤溶液的浓度增大,pH变大,故答案为:①;


科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)![]() 3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是( )
3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是( )

A.反应物A的浓度:a点小于b点
B.该反应的某种生成物可能对反应起催化作用
C.曲线上的c、d两点都表示达到平衡状态
D.A的平均反应速率:ab段大于bc段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中无机氮的循环过程可用如图表示。下列说法正确的是(已知:反应④的离子方程式为4NH4+ + 5O2![]() 2NO2- + 6H+ + N2O + 5H2O)
2NO2- + 6H+ + N2O + 5H2O)

A. ①②均属于固氮反应
B. 海洋中的反硝化作用一定需要氧气参加
C. 反应④中每生成1 mol H2O转移2 mol e-
D. 向海洋排放含NO3-的废水可能影响海洋中氮的循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的密闭容器中混合,并在一定条件下发生如下反应:A(g)+B(g)![]() 2C(g),反应2 s后测得C的物质的量为1.2 mol。下列说法正确的是
2C(g),反应2 s后测得C的物质的量为1.2 mol。下列说法正确的是
A. 用物质A表示2 s内的平均反应速率为0.3 mol·L-1·s-1
B. 用物质B表示2 s内的平均反应速率为0.6 mol·L-1·s-1
C. 单位时间内有a molA生成,同时就有2a molC生成
D. 当A、B、C表示的反应速率之比为1∶1∶2时达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当今环境保护越来越受重视,某化工集团为减少环境污染,提高资源的利用率、将钛厂、氯碱厂、甲醇厂进行联合生产。其主要生产工艺如下:(FeTiO3中Ti为+4价)

下列叙述正确的是
A. 该流程中只有“电解”、“氯化”涉及氧化还原反应
B. “氯化”时每消耗36g焦炭,则转移7mol电子
C. “合成”反应中氧化剂与还原剂的物质的量之比为1:1
D. 上述流程中“Mg,Ar"可用“Mg,CO2”代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极; ②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D![]() 导线
导线![]() C ; ③ A、C用导线相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡; ④B、D用导线相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是 ( )
C ; ③ A、C用导线相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡; ④B、D用导线相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是 ( )
A. A> B > C > D B. A > C > D > B
C. C > A > D > B D. C > B > D > A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,175℃时分解。
Ⅰ.用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。
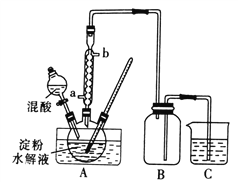
实验步骤如下
①糖化:先将淀粉水解为葡萄糖;
②氧化:在淀粉水解液中加入混酸(质量之比为3:2的65%HNO3与98%HSO4的混合物),在55~60℃下水浴加热发生反应;
③结晶、蒸发、干燥:反应后溶液经冷却、减压过滤,即得草酸晶体粗产品。
(1)装混酸的仪器名称为________;步骤②中,水浴加热的优点为__________。
(2)“②氧化”时发生的主要反应如下,完成下列化学方程式:
___C6H12O6+___HNO3 ![]() ___H2C2O4+9NO2↑+3NO↑+ ______
___H2C2O4+9NO2↑+3NO↑+ ______
(3)称取mg草酸晶体粗产品,配成100mL溶液。取20.00mL于锥形瓶中,用amoL·L-1KMnO4标准液标定,只发生
5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O反应,消耗KMnO4标准液体积为VmL,则所得草酸晶体(H2C2O4·2H2O)的纯度为___________。
Ⅱ.证明草酸晶体分解得到的产物
(4)甲同学选择下述装置验证产物CO2,装置B的主要作用是__________。
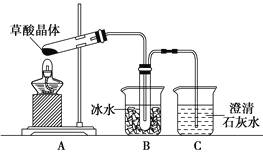
(5)乙同学认为草酸晶体分解的产物中除了CO2、H2O应该还有CO,为进行验证,选用甲同学实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。
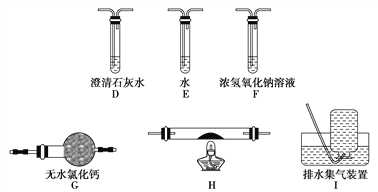
①乙同学的实验装置中,依次连接的合理顺序为A、B、_____________。其中装置H反应管中盛有的物质是________________________。
②能证明草酸晶体分解产物中有CO的现象是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用下面图象表示的是( )

反应 | 纵坐标 | 甲 | 乙 | |
A | SO2与O2在同温、同体积容器中反应 | SO2的转化率 | 2 mol SO2和 1 mol O2 | 2 mol SO2和 2 mol O2 |
B | 一定质量的氮气和氢气,在同一固定容积的容器中反应 | 氨气的浓度 | 400 ℃ | 500 ℃ |
C | 2 mol SO2与1 mol O2在同温、体积可变的恒压容器中反应 | SO2的转化率 | 1×106 Pa | 1×105 Pa |
D | 体积比为1:3的N2、H2在同温、体积可变的恒压容器中反应 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com