
 HCO3-+OH-£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©£»
HCO3-+OH-£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©£»·ÖĪö Ģ¼ĖįÄĘČÜŅŗÖŠĢ¼ĖįøłĄė×ÓĖ®½āĻŌŹ¾¼īŠŌ£¬Ė®½ā¹ż³ĢŹĒĪüČČµÄ£¬¼ÓČČ»į“Ł½ųĖ®½āµÄ½ųŠŠ£¬Ģ¼ĖįÄĘæÉŅŌŗĶĀČ»ÆøĘÖ®¼ä·¢Éś·“Ó¦£¬Éś³ÉĢ¼ĖįøĘ³ĮµķŗĶĀČ»ÆÄĘ£»Ģ¼ĖįÄĘŗĶŃĪĖįÖ®¼ä·“Ó¦£¬ĻČŹĒÉś³ÉĢ¼ĖįĒāÄĘŗĶĀČ»ÆÄĘ£¬Ėę×ÅŃĪĖįĮæµÄŌö¼Ó£¬Ģ¼ĖįĒāÄĘŗĶŃĪĖįÖ®¼ä·“Ӧɜ³ÉĀČ»ÆÄĘ”¢Ė®ŅŌ¼°¶žŃõ»ÆĢ¼£®
½ā“š ½ā£ŗĢ¼ĖįÄĘČÜŅŗÖŠĢ¼ĖįøłĄė×ÓĖ®½āĻŌŹ¾¼īŠŌ£¬¼“CO32-+H2O  HCO3-+OH-£¬Ė®½ā¹ż³ĢŹĒĪüČČµÄ£¬¼ÓČČ»į“Ł½ųĖ®½āµÄ½ųŠŠ£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬¼“¼ÓČČ¼īŠŌŌöĒ棬ĖłŅŌŗģÉ«¼ÓÉī£¬Ģ¼ĖįÄĘÖŠ¼ÓČėĀČ»ÆøĘ£¬Ģ¼ĖįÄĘæÉŅŌŗĶĀČ»ÆøĘÖ®¼ä·¢Éś·“Ó¦£¬Éś³ÉĢ¼ĖįøĘ³ĮµķŗĶĀČ»ÆÄĘ£¬³öĻÖ°×É«³Įµķ£¬Ėę×ÅĢ¼ĖįÄʵÄĻūŗÄ£¬ŗģÉ«±äĒ³ÖĮĻūŹ§£¬Ģ¼ĖįÄĘŗĶŃĪĖįÖ®¼ä·“Ó¦£¬ĻČŹĒÉś³ÉĢ¼ĖįĒāÄĘŗĶĀČ»ÆÄĘ£¬¼“CO32-+H+=HCO3-£¬Ėę×ÅŃĪĖįĮæµÄŌö¼Ó£¬Ģ¼ĖįĒāÄĘŗĶŃĪĖįÖ®¼ä·“Ӧɜ³ÉĀČ»ÆÄĘ”¢Ė®ŅŌ¼°¶žŃõ»ÆĢ¼£®
HCO3-+OH-£¬Ė®½ā¹ż³ĢŹĒĪüČČµÄ£¬¼ÓČČ»į“Ł½ųĖ®½āµÄ½ųŠŠ£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬¼“¼ÓČČ¼īŠŌŌöĒ棬ĖłŅŌŗģÉ«¼ÓÉī£¬Ģ¼ĖįÄĘÖŠ¼ÓČėĀČ»ÆøĘ£¬Ģ¼ĖįÄĘæÉŅŌŗĶĀČ»ÆøĘÖ®¼ä·¢Éś·“Ó¦£¬Éś³ÉĢ¼ĖįøĘ³ĮµķŗĶĀČ»ÆÄĘ£¬³öĻÖ°×É«³Įµķ£¬Ėę×ÅĢ¼ĖįÄʵÄĻūŗÄ£¬ŗģÉ«±äĒ³ÖĮĻūŹ§£¬Ģ¼ĖįÄĘŗĶŃĪĖįÖ®¼ä·“Ó¦£¬ĻČŹĒÉś³ÉĢ¼ĖįĒāÄĘŗĶĀČ»ÆÄĘ£¬¼“CO32-+H+=HCO3-£¬Ėę×ÅŃĪĖįĮæµÄŌö¼Ó£¬Ģ¼ĖįĒāÄĘŗĶŃĪĖįÖ®¼ä·“Ӧɜ³ÉĀČ»ÆÄĘ”¢Ė®ŅŌ¼°¶žŃõ»ÆĢ¼£®
¹Ź“š°øĪ»£ŗČÜŅŗ±äŗģ£Ø2·Ö£©£¬CO32-+H2O?HCO3-+OH-£Ø2·Ö£©£»ŗģÉ«¼ÓÉī£¬ŃĪµÄĖ®½ā·“Ó¦ĪüČČ£¬¼ÓČČ“Ł½ųCO32-Ė®½ā£¬OH-ÅضČŌö“ó£¬ŗģÉ«¼ÓÉī£»°×É«³Įµķ£¬ŗģÉ«±äĒ³ÖĮĻūŹ§£»CO32-+H+=HCO3-£®
µćĘĄ ±¾Ģāæ¼²éѧɜŃĪµÄĖ®½āŌĄķŅŌ¼°Ė®½āĘ½ŗāŅʶÆÖŖŹ¶£¬×¢ŅāÖŖŹ¶µÄ¹éÄÉŗĶŹįĄķŹĒ½āĢāµÄ¹Ų¼ü£¬ÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
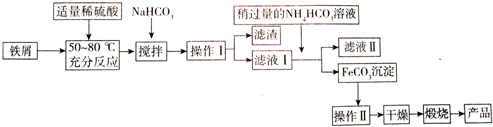
| ³ĮµķĪļ | Fe£ØOH£©3 | Fe£ØOH£©2 | Al£ØOH£©3 |
| æŖŹ¼³Įµķ | 2.3 | 7.5 | 3.4 |
| ³ĮµķĶźČ« | 3.2 | 9.7 | 4.4 |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ČōijĪĀ¶ČĻĀ£¬·“Ó¦ŗó$\frac{c£ØC{l}^{-}£©}{c£ØCl{O}^{-}£©}$=2£¬ŌņČÜŅŗÖŠ$\frac{c£ØCl{O}^{-}£©}{c£ØCl{O}_{3}^{-}£©}$=0.2 | |
| B£® | ²Ī¼Ó·“Ó¦µÄĀČĘųµÄĪļÖŹµÄĮæµČÓŚ0.5a mol | |
| C£® | øıäĪĀ¶Č£¬·“Ó¦ÖŠ×ŖŅʵē×ÓµÄĪļÖŹµÄĮæneµÄ·¶Ī§£ŗ$\frac{1}{2}$a mol”Üne”Ü$\frac{5}{6}$a mol | |
| D£® | øıäĪĀ¶Č£¬²śĪļÖŠKClO3µÄ×ī“óĄķĀŪ²śĮæĪŖ$\frac{a}{6}$mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĻūŗÄ1molAµÄĶ¬Ź±ĻūŗÄ1mol B | B£® | ĻūŗÄn molA£¬Ķ¬Ź±Éś³É2nmolC | ||
| C£® | ĘųĢåµÄ×ÜĢå»ż²»±ä | D£® | ČŻĘ÷ÄŚĘųĢåĆÜ¶Č²»±ä |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚ 101kPa ĻĀ£¬1æĖĪļÖŹČ¼ÉÕĖł·Å³öµÄČČĮ潊×öøĆĪļÖŹµÄČČÖµ | |
| B£® | ½šŹōµÄ·ĄøÆ“¦ĄķÖŠ£¬ĪžÉüŃō¼«µÄŅõ¼«±£»¤·ØŹĒµē½ā³ŲŌĄķµÄÓ¦ÓĆ | |
| C£® | »ī»Æ·Ö×Ó¼äµÄÅöײ¾ĶŹĒÓŠŠ§Åöײ | |
| D£® | “߻ƼĮÄÜŌö“óµ„Ī»Ģå»żÄŚ»ī»Æ·Ö×Ó°Ł·ÖŹż£¬“Ó¶ųŌö“ó·“Ó¦ĖŁĀŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
 ŌŚĘäĖūĢõ¼ž²»±äŹ±£¬øıäijŅ»Ģõ¼ž¶Ō A2£Øg£©+3B2£Øg£©?2AB3£Øg£©»ÆŃ§Ę½ŗāדĢ¬µÄÓ°Ļģ£¬µĆµ½ČēĶ¼ĖłŹ¾µÄ±ä»Æ¹ęĀÉ£ØĶ¼ÖŠT±ķŹ¾ĪĀ¶Č£©£¬ÓÉ“ĖæÉµĆ³öµÄ½įĀŪŹĒ£Ø””””£©
ŌŚĘäĖūĢõ¼ž²»±äŹ±£¬øıäijŅ»Ģõ¼ž¶Ō A2£Øg£©+3B2£Øg£©?2AB3£Øg£©»ÆŃ§Ę½ŗāדĢ¬µÄÓ°Ļģ£¬µĆµ½ČēĶ¼ĖłŹ¾µÄ±ä»Æ¹ęĀÉ£ØĶ¼ÖŠT±ķŹ¾ĪĀ¶Č£©£¬ÓÉ“ĖæÉµĆ³öµÄ½įĀŪŹĒ£Ø””””£©| A£® | T1£¼T2£¬Ę½ŗā³£Źż K1£¼K2 | |
| B£® | “ļµ½Ę½ŗāŹ± A2 µÄ×Ŗ»ÆĀŹ“óŠ”ĪŖ b£¾a£¾c | |
| C£® | a”¢b”¢c ČżµćµÄĘ½ŗā³£Źż Kb£¾Ka£¾Kc | |
| D£® | “ļµ½Ę½ŗāŹ±£¬AB3 µÄĪļÖŹµÄĮæ“óŠ”ĪŖ c£¾b£¾a |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÓÉ0.1mol•L-1µÄCH3COOHČÜŅŗÓė0.1 mol•L-1µÄNaOHČÜŅŗµČĢå»ż»ģŗĻ¶ų³É | |
| B£® | ÓÉ10mLpH=3µÄCH3COOHČÜŅŗÓė1 mL pH=11µÄNaOHČÜŅŗ»ģŗĻ¶ų³É | |
| C£® | ÓÉ0.1mol•L-1µÄCH3COONaČÜŅŗÓė0.1 mol•L-1µÄNaOHČÜŅŗµČĢå»ż»ģŗĻ¶ų³É | |
| D£® | ÓÉ0.1mol•L-1µÄCH3COONaČÜŅŗÓė0.1 mol•L-1µÄCH3COOHČÜŅŗµČĢå»ż»ģŗĻ¶ų³É |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ō×Ó¾§ĢåÖŠÖ»“ęŌŚ·Ē¼«ŠŌ¹²¼Ū¼ü | |
| B£® | øɱłÉż»ŖŹ±£¬·Ö×ÓÄŚ¹²¼Ū¼ü»į·¢Éś¶ĻĮŃ | |
| C£® | ÓÉŌ×Ó¹¹³ÉµÄ¾§ĢåæÉŅŌŹĒŌ×Ó¾§Ģ壬Ņ²æÉŅŌŹĒ·Ö×Ó¾§Ģå | |
| D£® | Ö»ŅŖŗ¬ÓŠ½šŹōŃōĄė×ӵľ§Ģå¾ĶŅ»¶ØŹĒĄė×Ó¾§Ģå |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com