
分析 ①先求出浓硫酸的物质的量浓度,然后根据稀释定律C浓V浓=C稀V稀来计算;
②浓硫酸稀释放热,要将浓硫酸注入水中;待溶液冷却后,将溶液注入容量瓶,移液时用玻璃棒引流;容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液,据此选择;
③在配制溶液的过程中要防止硫酸的损失,故烧杯要洗涤2-3次,并据此分析洗涤液的处理;
④定容时,开始直接向容量瓶中倒水,后来改用胶头滴管逐滴注入;
⑤定容后要将溶液摇匀,容量瓶不能盛放溶液,据此分析.
解答 解:①98%,密度为1.84g•cm-3的浓硫酸的物质的量浓度c=$\frac{1000×1.84g/mL×98%}{98g/mol}$=18.4mol/L,设所需浓硫酸的体积为VmL,根据稀释定律C浓V浓=C稀V稀可知:18.4mol/L×VmL=2mol/L×100mL,解得V=10.9mL,故答案为:10.9;
②浓硫酸稀释放热,要将浓硫酸注入水中,方法是:将浓硫酸沿烧杯内壁注入烧杯中的水中,变倒边搅拌,待溶液冷却后,将溶液沿玻璃棒注入100mL容量瓶中,故答案为:沿烧杯内壁缓慢;烧杯;搅拌;冷却;玻璃棒;100;
③烧杯要洗涤2-3次,将洗涤液也注入容量瓶中,防止硫酸的损失,故答案为:2-3;容量瓶;
④定容是,要向容量瓶内加水至刻度线1-2cm时,改用胶头滴管小心加水至溶液凹液面与刻度线相切,故答案为:1-2cm;胶头滴管;
⑤定容后要将溶液摇匀,而容量瓶不能用于盛装溶液,故配制好溶液后要装瓶,故答案为:摇匀;试剂瓶.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和操作,属于基础型题目,难度不大.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:解答题
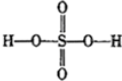 过硫酸:
过硫酸: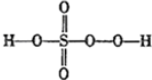
 (b)
(b) (c)H2O2(d)
(c)H2O2(d) (e)
(e) (f)
(f)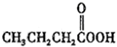 (g)O3(h)
(g)O3(h)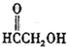
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C与14C | B. | CH3CH2OH与CH3COOH | ||
| C. | 甲烷与丙烷 | D. | CH3CH2CH2CH3与CH3CH(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数是60 | B. | 质子数是60 | C. | 中子数是33 | D. | 电子数是27 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| B. | 乙烯的燃烧:CH2=CH2+3O2$\stackrel{点燃}{→}$ 2CO2+2H2O | |
| C. | Fe2O3+6HCl═2FeCl3+3H2O | |
| D. | Na2CO3+H2O+CO2═2NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com