
 |  |  | 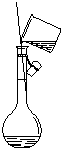 |
| A用海水制蒸馏水 | B将碘水中的碘单质与水直接分离 | C除去Fe(OH)3胶体中的FeCl3 | D稀释浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
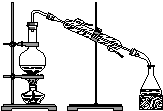
分析 A.利用沸点差异蒸馏海水可得蒸馏水;
B.将碘水中的碘单质与水分离,应先萃取再蒸馏;
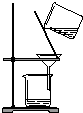
C.应用渗析的方法分离;
D.不能在容量瓶中稀释浓硫酸.
解答 解:A.利用沸点差异蒸馏海水可得蒸馏水,图中蒸馏装置合理,故A正确;
B.分离碘和水,应加入苯或四氯化碳进行萃取,分液后再蒸馏,不能用分液的方法直接分离碘和水,故B错误;
C.胶体、溶液都可透过滤纸,不能用过滤的方法分离,应用半透膜渗析分离,故C错误;
D.容量瓶只能在常温下使用,不能在容量瓶中稀释浓硫酸,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离、提纯的考查,综合性较强,侧重分离原理、物质性质及实验装置的考查,注意选项A中胶体的性质为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题
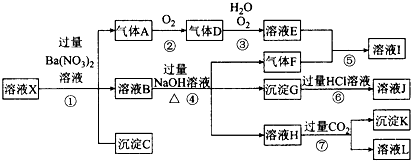
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.025mol•L-1•s-1 | B. | 0.0125mol•L-1•s-1 | ||
| C. | 0.05mol•L-1•s-1 | D. | 0.1mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | |
| B. | 用托盘天平称取5.20g氯化钠 | |
| C. | 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从上口倒出 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成n mo1 O2的同时生成n mol NO2 | |
| B. | 单位时间内生成n mol O2的同时生成2n molNO | |
| C. | 混合气体的颜色不再改变 | |
| D. | 混合气体的平均密度不再改变的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量的氢氧化钠固体 | B. | 向水中加入少量的五水硫酸铜晶体 | ||
| C. | 向水中加入少量的碳酸钠固体 | D. | 将水加热到95℃,使水的pH=6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
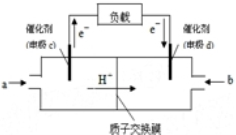 随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求.
随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com