
分析 (1)列出三段式计算,依据依据化学反应速率是单位时间内物质浓度的变化计算得到;
(2)依据三段式结合变化量之比=化学方程式的系数之比计算判断;
(3)依据计算得到的系数和(1)三段式列式数据,计算转化率;
(4)依据平衡移动原理结合D物质的量变化,判断反应进行的方向,再判断正反应是吸热还是放热.
解答 解:(1)根据题干信息结合平衡三段式列式,A减少量和生成C的物质的量之比等于速率之比等于计量数之比,平均反应速率vC=vA/2,
xA(g)+yB(g)?pC(g)+qD(g)
起始量(mol) a b 0 0
变化量(mol) $\frac{1}{3}$a $\frac{a}{2}$ $\frac{a}{6}$ a
平衡量(mol) $\frac{2}{3}$a b-$\frac{a}{2}$ $\frac{a}{6}$ a
用A表示的反应速率vA=$\frac{\frac{\frac{a}{3}mol}{2L}}{2min}$=$\frac{a}{12}$mol•L-1•min-1
用B表示的反应速率vB=$\frac{\frac{\frac{a}{2}mol}{2L}}{2min}$=$\frac{a}{8}$mol•L-1•min-1;
故答案为:$\frac{a}{12}$ mol•L-1•min-1;$\frac{a}{8}$mol•L-1•min-1;
(2)依据(1)的列式计算x:y:p:q=$\frac{a}{3}$:$\frac{a}{2}$:$\frac{a}{6}$:a=2:3:1:6,
x=2,y=3,p=1,q=6;
故答案为:2;3; 1; 6;
(3)反应平衡时,D为 2amol,则a=2amol,则B的转化率为=$\frac{\frac{a}{2}}{b}$×100%=$\frac{a}{b}$×100%=$\frac{a}{b}$×100%,故答案为:$\frac{a}{b}$×100%;
(4)依据(3)的平衡物质的量,如果只升高反应温度,其他反应条件不变,平衡时D为 1.5a mol,说明升温平衡逆向进行,逆向是吸热反应,正向是放热反应,△H<0;
故答案为:<.
点评 本题考查了化学反应速率的计算判断,化学平衡影响因素的分析理解,三段式计算的应用,物质转化率的计算,掌握化学平衡的基础是解题关键,题目难度中等


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(W)>r(Z)>r(Y) | |
| B. | Z的最高价氧化物对应水化物的碱性比W的强 | |
| C. | 化合物X2Y2和Z2Y2所含化学键类型完全相同 | |
| D. | 工业上常用电解熔融W的氧化物制备W的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
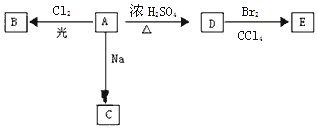
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水溶液中可以显酸性的物质是酸 | |
| B. | 电离时产生的阳离子中有H+的化合物是酸 | |
| C. | 电离时产生的阴离子全部是OH-的化合物是碱 | |
| D. | 盐只能电离出金属阳离子和酸根离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配合物中中心原子的电荷数和配位数均为6 | |
| B. | Pt4+提供孤对电子 | |
| C. | Cl-和NH3分子均与Pt4+配位 | |
| D. | 配合物中Cl-与Pt4+配位,而NH3分子不配位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲酸香叶脂(结构如图)为无色透明液体,具有新鲜蔷薇嫩叶的香味,可用于配制香精.下列有关该有机物的叙述正确的是( )
甲酸香叶脂(结构如图)为无色透明液体,具有新鲜蔷薇嫩叶的香味,可用于配制香精.下列有关该有机物的叙述正确的是( )| A. | 分子式为C11H18O2 | |
| B. | 含有羧基和碳碳双键两种官能团 | |
| C. | 能发生加成反应和水解反应 | |
| D. | 23gNa与过量的该物质反应生成标准状况下11.2L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5Cl2+I2+6H2O=10HCl+2HIO3 | |
| B. | 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O | |
| C. | MnO2+4HCl=MnCl2+2H2O+Cl2↑ | |
| D. | 2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$ 2NaOH+Cl2↑+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com