
| A. | 醋酸溶液的pH大于盐酸 | |
| B. | 醋酸溶液的pH小于盐酸 | |
| C. | 分别用水稀释相同倍数后,所得溶液中:c(Cl-)═c(CH3COO-) | |
| D. | 两种溶液中水的电离程度相同 |
分析 已知c(Cl-)═c(CH3COO-),据电荷守恒可知两溶液中氢离子浓度相同,则溶液pH相同;加水稀释时,醋酸电离平衡正向移动,醋酸根离子的物质的量增大,而氯离子的物质的量不变,则稀释后c(Cl-)<c(CH3COO-);两溶液都与抑制了水的电离,由于氢离子浓度相同,则两种溶液中水的电离程度相同,据此进行解答.
解答 解:A.据电荷守恒,c(Cl-)═c(CH3COO-)则氢离子浓度相同,溶液pH相同,故A错误;
B.两溶液中氢离子浓度相同,溶液的pH相同,故B错误;
C.加水稀释时,醋酸电离平衡正向移动,醋酸根离子的物质的量增大,而氯离子的物质的量不变,根据c=$\frac{n}{V}$可知稀释后c(Cl-)<c(CH3COO-),故C错误;
D.盐酸和醋酸溶液都抑制了水的电离,两溶液中的氢氧根离子是水电离的,由于氢氧根离子浓度相同,则两种溶液中水的电离程度相同,故D正确;
故选D.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度不大,明确弱电解质的电离特点为解答关键,注意掌握影响弱电解质电离的因素,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:实验题
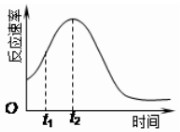 某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种.
某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种.| 试管A | 试管B | |
| 加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4,少量MnSO4(s)固体(填物质名称) |
| 实验现象(褪色时间) | 褪色时间10min | 褪色时间<10min(选填“<”“>”或“=”) |
| 结论 | 猜想Ⅱ正确 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 18种 | C. | 9种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素一定被氧化 | B. | 该元素一定被还原 | ||
| C. | 该元素可能被氧化也可能被还原 | D. | 生成的单质为还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备无水AlCl3时,加入的SOCl2只起脱水剂作用 | |
| B. | 电池工作过程中,SOCl2被还原为Li2SO3和S单质 | |
| C. | 电池工作过程中,电子经电解质溶液流向锂电极 | |
| D. | 用该电池电解水,生成2mol H2,消耗1.5molSOCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6Cl2有4种同分异构体 | |
| B. | 1,4-二甲基苯也称为间二甲苯 | |
| C. | 乙烯使溴水和高锰酸钾溶液褪色的原理相同 | |
| D. | 煤的干馏和石油的分馏均为物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | ① | ② | ③ | ④ |
| 溶液 | NaCl | CH3COONH4 | NaHCO3 | 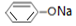 |
| pH | 7.0 | 7.0 | 8.4 | 9.9 |
| A. | 酸性:H2CO3>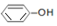 | |
| B. | 水电离产生的c(H+):①=② | |
| C. | 溶液③中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1mol•L-1 | |
| D. | 溶液④中:c(Na+)>c(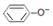 )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,用化学方程式表示出它作供氧剂的原理:2CaO2+2H2O=2Ca(OH)2+O2↑.
,用化学方程式表示出它作供氧剂的原理:2CaO2+2H2O=2Ca(OH)2+O2↑.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)>c(Cl-)>c(OH- )>c( H+ ) | B. | c(Cl-)>c(NH4+)>c( H+ )>c(OH-) | ||
| C. | c(NH4+)+c( H+ )=c(Cl-)+c(OH- ) | D. | c(NH4+)+c( NH3•H2O )=c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com